
����Ŀ����֪A��B��F�Ǽ�ͥ�г������л��A����������ȥůƿ��ˮ���е�ˮ����E��ʯ�ͻ�����չˮƽ�ı�־��F��һ�ֳ����ĸ߷��Ӳ��ϡ���������ת����ϵ�ش��������⣺
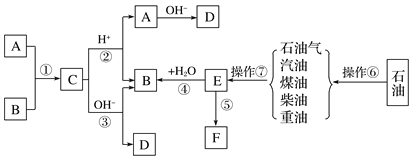
��1�������ޡ������ߵ����Ʒֱ�Ϊ________________��________________��
��2��E�Ľṹ��ʽΪ_________��
��3��B�Ĺ���������Ϊ________����B��������ȷ����________��
���ж� ������ɫ��ζ ���ܶȱ�ˮС�� �������Ը��������Һ��Ӧʹ����ɫ
���ں������ʵ��������ȡ���ӵ�ˮ����ȡ�ⵥ��
������Cu˿������������Է�����������С2���л���
A���٢ۢ� B���ڢۢ� C���ۢܢ� D���ܢݢ�
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��д������18O��A����18O��ǵ�B��һ�������·�����Ӧ�Ļ�ѧ����ʽ(ע��������18O��λ��)��
_______________________________________________________________________��
��E��ˮ��Ӧ����B�ķ���ʽ(ע������)��
_______________________________________________________________________��
����Ϊ��ͥ�г���������,�߷��ӻ�����F�����Ǵ����˼���ķ��㣬ͬʱҲ����˻�����Ⱦ����Ӧ�ݵķ���ʽΪ��___________________________________________________________��
д���л���B�������ȵ�ͭ˿�ڿ����з�Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
���𰸡� ���� �ѽ� CH2=CH2 �ǻ� C  CH2===CH2��H2O
CH2===CH2��H2O![]() CH3CH2OH
CH3CH2OH ![]() 2CH3CH2OH��O2
2CH3CH2OH��O2![]() 2CH3CHO��2H2O
2CH3CHO��2H2O
��������E��ʯ�ͻ�����չˮƽ�ı�־��EΪ��ϩ��ʯ�ͷ���õ����͡�ú�͡����͵������ͣ��ѽ�õ���ϩ����ϩ�����Ӿ۷�Ӧ����F��FΪ����ϩ��Ӱ����ˮ�ӳ�����B��BΪ�Ҵ���A����������ȥůƿ��ˮ���е�ˮ����AΪ���ᣬ�������Ҵ�����������Ӧ����C��CΪ����������C������������ˮ�������Ҵ������ᣬ�ڼ���������ˮ�������Ҵ��������ơ�
(1)��ʯ�͵õ����͡�ú�͡����͵������͵IJ����Ƿ�����ʯ�Ͳ�Ʒ��ȡ��ϩ�IJ������ѽ�(����ѻ�)���ʴ�Ϊ�������ѽ⣻
(2)EΪ��ϩ���ṹ��ʽΪCH2=CH2���ʴ�Ϊ��CH2=CH2��
(3)BΪ�Ҵ���������Ϊ�ǻ��� ���Ҵ����������Ҵ������������ζ�������Ҵ����ܶȱ�ˮС����ȷ�����Ҵ��ܹ������Ը��������Һ��������ʹ���������Һ��ɫ����ȷ�����Ҵ�������ˮ�������ں������ʵ��������ȡ���ӵ�ˮ����ȡ�ⵥ�ʣ���������Cu˿�����£��Ҵ�������������Է�����������С2���л�����ȩ����ȷ����ȷ���Тۢܢޣ���ѡC���ʴ�Ϊ���ǻ���C��
(4)�ٲ���18O����������18O��ǵ��Ҵ���һ�������·�����Ӧ�Ļ�ѧ����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
����ϩ��ˮ�����ӳɷ�Ӧ����B�ķ���ʽΪCH2=CH2��H2O![]() CH3CH2OH���ʴ�Ϊ��CH2=CH2��H2O
CH3CH2OH���ʴ�Ϊ��CH2=CH2��H2O![]() CH3CH2OH��
CH3CH2OH��
����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ�ķ���ʽΪ![]() ���Ҵ��������ȵ�ͭ˿�ڿ����з�������������Ӧ�Ļ�ѧ����ʽ2CH3CH2OH��O2
���Ҵ��������ȵ�ͭ˿�ڿ����з�������������Ӧ�Ļ�ѧ����ʽ2CH3CH2OH��O2![]() 2CH3CHO��2H2O���ʴ�Ϊ��
2CH3CHO��2H2O���ʴ�Ϊ��![]() ��2CH3CH2OH��O2
��2CH3CH2OH��O2![]() 2CH3CHO��2H2O��
2CH3CHO��2H2O��


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Լռ����������71%������ʮ�־�Ŀ���DZ����ͨ����ˮ���ۺ����ÿɻ���������ʹ�����ʹ�ã�
��1����ˮ���Ƶõ��Ȼ��Ƴ�ʳ���⣬��������ҵԭ�ϣ�����ͨ����NaCI��CO2��NH3Ϊԭ����ȡ�����д����һ����ȡNaHCO3�Ļ�ѧ����ʽ�� ��
��2����ҵ����Ũ����ˮΪԭ����ȡ��IJ���������ͼ1��
��֪��Br2�����³�Һ̬���ӷ����ж���2Br2+3CO32��=5Br��+BrO3��+3CO2 ��
��ͨ����������������ѻ�ú�Br2����Һ��Ϊ�λ��辭�����������ա��ữ�����»�ú�Br2����Һ��ԭ���� ��
�ڷ�Ӧ��2�з�����Ӧ�����ӷ���ʽΪ ��
������������ͨ��ˮ�������ȣ������¶���90�����ҽ��������ԭ���� ��
��3������±������ȴ������±�����Ҫ�ɷ���MgCI2 �� �������Fe2+��Fe3+��Mn2+�����ӣ���±��Ϊԭ���Ƶ�þ�Ĺ���������ͼ2�����ֲ�������������ȥ����
�����������������pH
���� | ��ʼ���� | ������ȫ |
Fe��OH��3 | 2.7 | 3.7 |
Fe��OH��2 | 7.6 | 9.6 |
Mn��OH��2 | 8.3 | 9.8 |
Mg��OH��2 | 9.6 | 11.1 |
����NaClO����Fe2+�õ�Fe��OH��3���������ӷ�Ӧ����ʽ�� ��
�ڲ��������HCl�������м��Ƚ��У����û�ѧƽ���ƶ�ԭ������ԭ�� ��
��NaClO���ܳ�ȥ��±�е�CO��NH2��2 �� �����κ��ܲ������ѭ�������ʣ���ȥ0.1molCO��NH2��2ʱ����NaCIOg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�á�������������ȷ����(����)

A. a��b�õ�������ʱ����Ƭ�Ϸ����ķ�ӦΪFe��3e��===Fe3��
B. a��b�õ�������ʱ��ͭƬ�Ϸ����ķ�ӦΪCu2����2e��===Cu
C. ����a��b�Ƿ����ӣ���Ƭ�����ܽ⣬��Һ����ɫ���dz��ɫ
D. a��b������ʱ����Ƭ�ϻ��н���ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����4gNH3�к���x��NH3���ӣ���ô8gH2S�к��еĵ�����Ϊ
A.xB.3.4xC.12xD.18x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����±�������Ժ�ijЩ������Ӧ�������������л���������������뺬�ʻ��� ![]() ���Ļ����ﷴӦ���ɴ���
���Ļ����ﷴӦ���ɴ��� ![]()
�ڱ���AlCl3����������±�������·�Ӧ��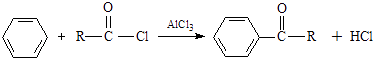
�л���E�ɾ�����·�ߺϳɣ�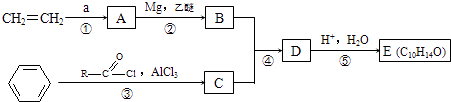
E���Ʒ�Ӧ�ų���������ͨ�����ܱ�����������ȩ��ͪ��E�����Ṳ�ȵ�һ���¶ȿɵõ�F��G��F����������̼ԭ�Ӿ��ɹ�����ͬһƽ���ϣ���Gȴ���ɣ��ش��������⣺
��1��E��F��G�Ľṹ��ʽ�ֱ��ǣ�E �� F �� G ��
��2��д�����л�ѧ��Ӧ����ʽ���� �� �� ��
��3��E����E��ͬ���칹������E��ͬһ�����E�䲻�ܴ��ʻ�������ֱ�Ӽ��ԭ�õ�����E����ܵĽṹ��ʽΪ����E����Ũ���Ṳ�Ȳ��ܵõ�̼�������ϩ������E����ܵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ú��Ʒ����ˮú������̿�����ѵȣ��ѹ㷺Ӧ���ڹ�ũҵ�����У�
��1����֪��C��s��+H2O��g��=CO��g��+H2��g����H=+131.3kJ��mol��l
CO2��g��+H2��g��=CO��g��+H2O��g����H=+41.3kJ��mol��l
��̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ �� �÷�Ӧ��������¡��������¡����κ��¶ȡ����������������Է����У�
��2������̿��ԭ���ɴ������������NO�ȣ��������ķ�ӦΪC��s��+2NO��g��N2��g��+CO2 ��g������ij�ܱ������м���һ�����Ļ���̿��NO����T1��ʱ����ͬʱ���õĸ������Ũ�������ʾ��
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��10��20min�ڣ�N2��ƽ����Ӧ���ʿ�v��N2��= ��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������������ĸ����
A��ͨ��һ������NO B������һ�����Ļ���̿
C��������ʵĴ��� D���ݵ���С���������
��3���о���������ӦCO��g��+H2O��g��H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����Ӧ��500��ʱ���У�����ʼʱCO��H2O��Ũ�Ⱦ�Ϊ0.020molL��l �� �ڸ������´ﵽƽ��ʱ��CO��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯��������Ҫ��ӦΪ��CO��g��+ ![]() Fe2O3��s��CO2��g��+
Fe2O3��s��CO2��g��+ ![]() Fe��s�� ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
Fe��s�� ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
����˵����ȷ���ǣ� ��
A.����Fe2O3����������CO��ת����
B.�÷�Ӧ�ġ�H��0
C.��С�������������߷�Ӧ�����������ƽ��ת����
D.�����������ܶȺ㶨ʱ�����ܱ�־��Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽ�����黼��״���״�IJ��˶�Ժ������������ں����к��Ϸḻ�ģ� ��
A.��Ԫ��
B.��Ԫ��
C.��Ԫ��
D.пԪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̻�����������ˮ���ص���
A.������Һȥ����B.���ڳ�ʪ�Ļ���������
C.�����Ȼ�����Һ��ɫ����D.������ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com