
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属:X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是__________________。
(2)ZW2的电子式是___________,它在常温下呈液态,形成晶体时,属于________晶体。
(3)工业生产单质Y的原理是______________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是________________。
【答案】
(1)Cl<S<Al
(2)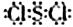 分子
分子
(3)2Al2O3 4Al+3O2↑
4Al+3O2↑
(4)Be+2NaOH=Na2BeO2+H2↑
(5)3︰5
【解析】由X的“最外层电子数与次外层电子数相等”,确定X为Be,电子层结构 。由X与W最外层电子数之和为9可知W的最外层电子数为7,可能为F或Cl。若W为F,则Y、Z是5~8号元素中的2种,不可能为金属,即X、Y、Z、W中只有X为金属Be,与题目要求不合,所以W为Cl,且Y、Z有一种为第三周期金属元素。考虑四种元素不同主族,且Y、Z的最外层电子数之和也为9,可确定Y为Al、Z为S。
。由X与W最外层电子数之和为9可知W的最外层电子数为7,可能为F或Cl。若W为F,则Y、Z是5~8号元素中的2种,不可能为金属,即X、Y、Z、W中只有X为金属Be,与题目要求不合,所以W为Cl,且Y、Z有一种为第三周期金属元素。考虑四种元素不同主族,且Y、Z的最外层电子数之和也为9,可确定Y为Al、Z为S。
因为还原性Fe2+>Br-,所以FeBr2溶液与Cl2先发生2Fe2++Cl2 = 2Fe3++2Cl-、再发生2Br-+Cl2 = Br2+2Cl-。反应中数量关系如下:
2Fe2+ + Cl2 = 2Fe3++2Cl-
0.075mol 0.0375mol
2Br- + Cl2 = Br2+2Cl-
0.0625mol×2=0.125mol 0.1mol-0.0375mol=0.0625mol
被氧化的Fe2+和Br-的物质的量之比为0.075mol:0.125mol=3:5


科目:高中化学 来源: 题型:
四种短周期元素在周期 表中的相对
表中的相对 位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X | Y | |
| Z | W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有_______种,金属性最强的元素与氧反应生成的化合物有______________(填两种化合物的化学式);
(2)属于稀有气体的是_________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是_______________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)____________;
(5)推测Si、N最简单氢化物的稳定性_________大于__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A. 第七周期 B.镭 第七周期
第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
查看答案和解析>>
科目:高中化学 来源: 题型:
题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23.(A)
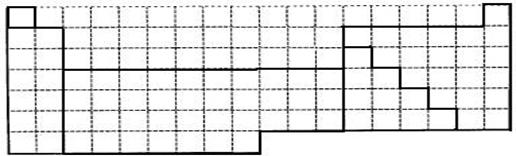
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在下边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:_____>_____甲、乙的最高价氧化物水化物的酸性强弱为:_____>_____(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的_________,请写出元素在元素周期表中的位置与元素原 子结构的关系:
子结构的关系:
___________________________________________________
(B)
下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。
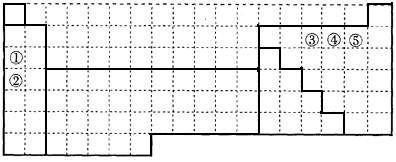
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子数比s电子总数多_______个。
元素③氢化物的电子式为_______。
(3)元素④一般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。
a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:

(1) 混合物中MgCl2的质量为_________g,混合物中AlCl3的质量为___________g,混合物中NaOH的质量为_____________g.
(2)P点表示盐酸的体积是____________mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com