
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
| A.酸碱恰好中和 | B.c1=c2 |
| C.滴人酚酞溶液呈浅红色 | D.所得溶液c(Na+)=c(CH3COO一) |
D
解析试题分析:醋酸是弱酸,部分电离,NaOH为强碱,完全电离。若c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后二者恰好发生中和反应,完全反应得到CH3COONa和水。则由于生成的CH3COONa是强碱弱酸盐,水解使溶液显碱性。为了抑制CH3COO-的水解,使所得溶液的pH=7,则CH3COOH应该稍微过量一些。所以c1>c2.所以A、B错误。由于溶液呈中性,所以c(H+)=c(OH-).滴人酚酞溶液后溶液不变色。即呈无色。C错误。任何溶液都符合电荷守恒。在CH3COONa溶液中,c(H+)+c(Na+)= c(OH-)+c(CH3COO一),而c(H+)=c(OH-),所以所得溶液c(Na+)=c(CH3COO一)。选项D正确。
考点:考查酸碱混合溶液中的离子浓度的大小、溶液的酸碱性的知识。


科目:高中化学 来源: 题型:单选题
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= mol·L-1,c(CH3COOH)= mol·L-1;
(3)CH3COOH的电离平衡常数Ka= (用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列比较中,正确的是
| A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN |
| B.物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C.0.1mol/L的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| D.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等量的锌粉,前者用时长 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下测得浓度均为0.1 mol·L—1的下列三种溶液的pH:
| 溶 质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 8.4 | 11.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
| A.0.01mol/L CH3COOH | B.0.01mol/L HNO3 |
| C.pH=2的H2SO4溶液 | D.pH=2的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各离子方程式中,属于水解反应且使溶液显碱性的是
| A.CH3COOH+OH-= CH3COO-+H2O |
B.H2O+H2O  H3O++OH- H3O++OH- |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.PO43-+H2O  HPO42-+OH- HPO42-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,微粒的物质的量浓度关系表述正确的是 ( )。
| A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—) |
| B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
| C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
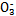 )>c(S
)>c(S )>c(OH-)
)>c(OH-)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com