
下列各离子方程式中,属于水解反应且使溶液显碱性的是
| A.CH3COOH+OH-= CH3COO-+H2O |
B.H2O+H2O  H3O++OH- H3O++OH- |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.PO43-+H2O  HPO42-+OH- HPO42-+OH- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
| A.酸碱恰好中和 | B.c1=c2 |
| C.滴人酚酞溶液呈浅红色 | D.所得溶液c(Na+)=c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则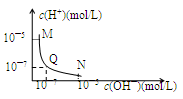
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO―)>c(Na+) |
| C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
| D.M点和N点所示溶液中H2O的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可以利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
| A.Na2CO3 NaHCO3 NaCl NH4Cl | B.Na2CO3 NaHCO3 NH4Cl NaCl |
| C.(NH4)2SO4 NH4Cl NaNO3 Na2S | D.NH4Cl (NH4)2SO4 Na2S NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用0.1000mol/LNaOH溶液分别滴定25.00mL0.1000mol/L盐酸溶液和
25.00mL0.1000mol/LCH3COOH溶液,滴定过程中pH变化曲线如下图所示。下列判断不正确的是
| A.滴定盐酸的pH变化曲线为图2 |
| B.在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–) |
| C.滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–) |
| D.当c(Na+)=c(CH3COO–)+ c(CH3COOH)时,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NH3·H2O溶液 | pH=11 NaOH溶液 | pH=1 H2SO4溶液 | pH=3 CH3COOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com