
【题目】已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是( )
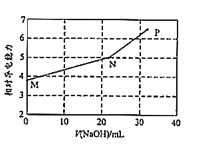
A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-)
B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+2c(HA-)
C.P点溶液中一定存在:c(Na+)>c(K+)>c(OH-)>c(A2-)
D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-)
【答案】B
【解析】
邻苯二甲酸氢钾KHA与氢氧化钠反应,HA-+OH-=A2-+H2O,到达N点后,溶液变为K2A和NaOH的混合溶液。
A. M点时,溶液为KHA,水解平衡常数Kb=![]() <Ka2,离子电离大于水解,即离子浓度:c(K+)>c(HA-)>c(A2-)>c(H2A),A错误;
<Ka2,离子电离大于水解,即离子浓度:c(K+)>c(HA-)>c(A2-)>c(H2A),A错误;
B. N点溶液为Na2A,根据电荷守恒可知,c(Na+)+c(K+)+c(H+)=2c(A2-)+2c(HA-)+c(OH-),溶液显碱性,c(H+)<c(OH-),故c(Na+)+c(K+)>2c(A2-)+2c(HA-),B正确;
C. P点氢氧化钠过量,溶液中存在:c(Na+)>c(OH-)>c(K+)>c(A2-),C错误;
D. 根据电荷守恒可知,溶液中恒存在c(Na+)+c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),D错误。
答案为B。


科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+ 6KOH== KIO3 +5KI+ 3H2O
反应II:3H2S+KIO3=3S↓+KI+ 3H2O
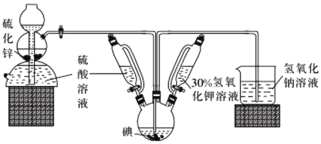
请回答有关问题。
(1)启普发生器中发生反应的化学方程式为________。装置中盛装30%氢氧化钾溶液的仪器名称是__________。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为______(填现象),停止滴人KOH溶液;然后________(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是_______________。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和____(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)实验室模拟工业制备KIO3流程如下:
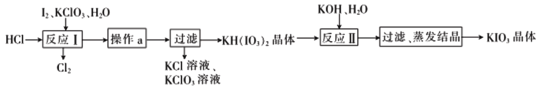
几种物质的溶解度见下表:
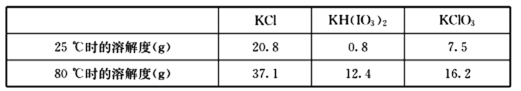
用惰性电极电解KI溶液也能制备KIO3,与电解法相比,上述流程制备KIO3的缺点是_________。
(6)某同学测定.上述流程生产的KIO3样品的纯度。
取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol·L-1 Na2S2O3溶液,恰好完全反应时共消耗12. 60 mL Na2S2O3溶液。该样品中KIO3的质量分数为___________(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是________;
(2)以上物质属于电解质的是________;
(3)以上物质属于非电解质的是_______;
(4)以上物质溶于水后形成的溶液能导电的是______;
(5)属于盐的有________;
(6)写出⑧溶于水中的电离方程式_____;
(7)分离胶体和溶液常用的方法叫__________;
(8)等质量的O2和O3所含原子个数比为______;
(9)设NA为阿伏加德罗常数的数值,若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________。(用含有NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出如图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
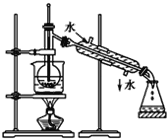
①___;②___。
(2)图是某学生的过滤操作示意图,其操作不规范的是___。
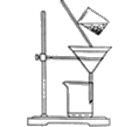
a.漏斗下口尖端未紧靠烧杯壁 b.玻璃棒有引流作用
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘低于漏斗口边缘
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①与SO42-互为等电子体的分子有___(写一种)。
②ClO2-中氯原子的孤电子对数为___。
③常用K3[Fe(CN)6]检验水中的Fe2+。K3[Fe(CN)6]的配体是___。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2__(填“>”“<”或“=”)Cl2O,理由是___。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(1)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了___。
,这样的书写不正确,违背了___。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是___。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为___。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是__。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如图所示:
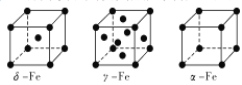
①δ、α两种晶体晶胞中铁原子的配位数之比为__,γ晶胞中实际拥有___个原子。
②若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为___g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为___。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
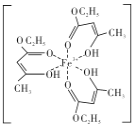
①此配合物中碳原子的杂化轨道类型有___。
②此配离子中含有的化学键有___(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.δ键 H.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:

下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com