
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①与SO42-互为等电子体的分子有___(写一种)。
②ClO2-中氯原子的孤电子对数为___。
③常用K3[Fe(CN)6]检验水中的Fe2+。K3[Fe(CN)6]的配体是___。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2__(填“>”“<”或“=”)Cl2O,理由是___。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(1)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了___。
,这样的书写不正确,违背了___。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是___。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为___。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是__。
【答案】CCl4或者SiF4 2 CN- < 物质相对分子质量越大,分子间作用力越大,熔沸点越高 洪特规则 乙醇分子间可形成分子间作用力和氢键,乙醛分子间只存在分子间作用力 sp2 Cu+没有未成对电子,
【解析】
I.(1)①等电子体指原子总数相同,价电子总数相同的分子;
②根据价层电子对互斥理论来确定其杂化方式,价层子对个数=![]() 键个数+孤电子对个数
键个数+孤电子对个数
③K3[Fe(CN)6]的中心离子为Fe,与中心离子成键的是配体;
(2)物质相对分子质量越大,分子间作用力越大,熔沸点越高;
Ⅱ.(1)①洪特规则指在等价轨道上排布的电子将尽可能分别占有不同的轨道,且自旋方向相同,据此判断;
②乙醇分子间可形成氢键,使沸点变高;
(2)计算硝酸中氮原子价层电子对数,进而确定氮原子轨道的杂化类型;
(3)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关。
I.(1)①等电子体指原子总数相同,价电子总数相同的分子,与SO42-互为等电子体的分子有CCl4或者SiF4等;
②ClO2-中氯原子的价层电子对数=2+![]() =4,其中孤电子对数为2;
=4,其中孤电子对数为2;
③K3[Fe(CN)6]的中心离子为Fe3+,与中心离子成键的是配体,即配体为CN-;
(2)物质相对分子质量越大,分子间作用力越大,熔沸点越高;ClO2的相对分子质量小于Cl2O,则有沸点ClO2<Cl2O;
Ⅱ.(1)①根据洪特规则可知电子尽可能分别占有不同的轨道,且自旋方向相同,电子排布图为:![]() ,本题违背了洪特规则;
,本题违背了洪特规则;
②乙醇分子间可形成分子间作用力和氢键,乙醛分子间只存在分子间作用力,因而乙醇的沸点远高于乙醛;
(2)硝酸中氮原子价层电子对数=3+![]() =3,因此N原子轨道的杂化类型为sp2杂化;
=3,因此N原子轨道的杂化类型为sp2杂化;
(3)金属阳离子在水溶液中的颜色与该金属阳离子d能级上的未成对电子数有关,Cu+的核外电子排布为[Ar]3d10,没有未成对电子,Cu+呈无色。
微粒 | 通式 | 价电子总数 | 立体构型 |
CO2、SCN-、NO | AX2 | 16e- | 直线形 |
CO | AX3 | 24e- | 平面三角形 |
AX2 | 18e- | V形 | |
SO | AX4 | 32e- | 正四面体形 |
PO | AX3 | 26e- | 三角锥形 |
CO、N2 | AX | 10e- | 直线形 |
CH4、NH | AX4 | 8e- | 正四面体形 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是![]()
![]()
石油![]() 分馏产品
分馏产品![]() 乙烯
乙烯![]() .
.
A. 石油主要是由烃组成的混合物
B. ![]() 主要发生物理变化
主要发生物理变化
C. ![]() 包括裂化、裂解等过程
包括裂化、裂解等过程
D. ![]() 是加成反应,产物名称是二溴乙烷
是加成反应,产物名称是二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH=CH2)的说法正确的是( )
A.丙烯分子中3个碳原子都是sp3杂化
B.丙烯分子有7个σ键,1个π键
C.丙烯分子存在非极性键
D.丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是( )
A | B | C | D |
|
|
|
|
银器用除锈剂除锈 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是( )
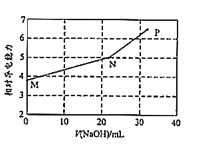
A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-)
B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+2c(HA-)
C.P点溶液中一定存在:c(Na+)>c(K+)>c(OH-)>c(A2-)
D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
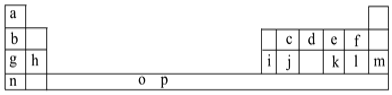
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___。
(2)d与a反应的产物的分子中中心原子的杂化形式为___,该分子是___(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___。
II.(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为__。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
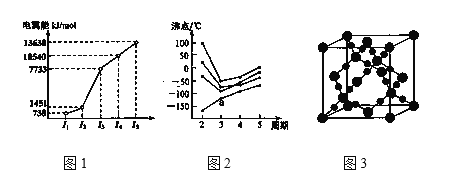
①第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
②CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
③如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是__。判断依据___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球性的问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。
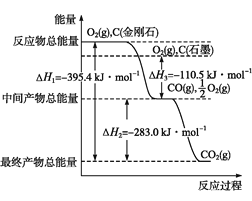
由上图可知,在通常状况下,金刚石和石墨中___(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__kJ·mol1
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol1、497 kJ·mol1,N2(g)+O2(g)=2NO(g) ΔH=180.0 kJ·mol1。NO分子中化学键的键能为_____kJ·mol1。
(4)综合上述有关信息,请写出CO和NO反应的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的 KCl 饱和溶液)
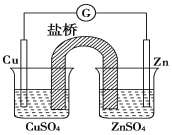
A.正极反应为 Zn- 2e- == Zn2+
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的 K+会移向 CuSO4 溶液
D.电子从负极流向正极,再经盐桥流回负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com