
【题目】铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,用于焙烤食品,可通过硫酸铝溶液和硫酸铵溶液反应制备。用芒硝(Na2SO410H2O)制备纯碱和铵明矾的生产工艺流程图如图1:
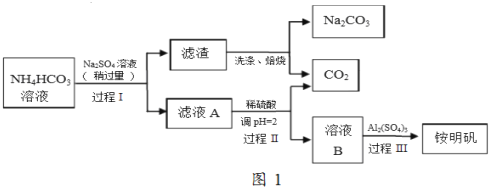
完成下列填空:
(1)铵明矾溶液呈_________性,它可用于净水,原因是_______________;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是__________________。
(2)写出过程Ⅰ的化学反应方程式_______________。
(3)若省略过程Ⅱ,直接将硫酸铝溶液加入滤液A中,铵明矾的产率会明显降低,原因是___________。
(4)已知铵明矾的溶解度随温度升高明显增大.加入硫酸铝后,经过程III的系列实验得到铵明矾,该系列的操作是加热浓缩、___________、过滤洗涤、干燥。
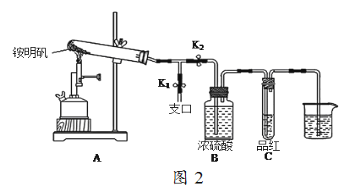
(5)某同学用图2图示的装置探究铵明矾高温分解后气体的组成成份。
①夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是______________;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是___________(任填一种物质的化学式);另分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式_______________。
②该同学通过实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=_____。
【答案】酸性 铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水 先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失 2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低 冷却结晶 打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟 (NH4)2SO3 Al2O3+2OH-=2AlO2-+H2O 1:3
【解析】
碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与滤液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及少量HCO3-等,加入硫酸,调节pH使HCO3-转化二氧化碳与,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾;
(1)铵明矾溶液中NH4+、铝离子水解NH4++H2ONH3·H2O+H+、Al3++3H2OAl(OH)3+3H+,促进水的电离,溶液呈酸性;铵明矾用于净水的原因是:铵明矾水解得到氢氧化铝胶体,氢氧化铝胶体可以吸附水中悬浮物,达到净水的目的;向铵明矾溶液中加入氢氧化钠溶液,首先Al3+与OH-反应生成氢氧化铝沉淀,接着NH4+与OH-反应生成氨气,最后加入的过量NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失。
(2)过程I利用溶解度不同发生复分解反应,反应方程式为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 。
(3)省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低。
(4)由于铵明矾的溶解度随温度升高明显增大,加入硫酸铝后从溶液中获得铵明矾的操作是:加热浓缩、冷却结晶、过滤洗涤、干燥。
(5)①检验氨气方法为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;装置A和导管中未见红棕色气体,说明没有生成氮的氧化物,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3,白色固体可能是(NH4)2SO3;装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝,氧化铝与氢氧化钠溶液反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
②反应中-3价的N化合价升高发生氧化反应生成N2,+6价的S化合价降低发生还原反应生成SO2,根据电子转移守恒:n(N2)×2×[0﹣(﹣3)]=n(SO2)×(6﹣4),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3。


科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
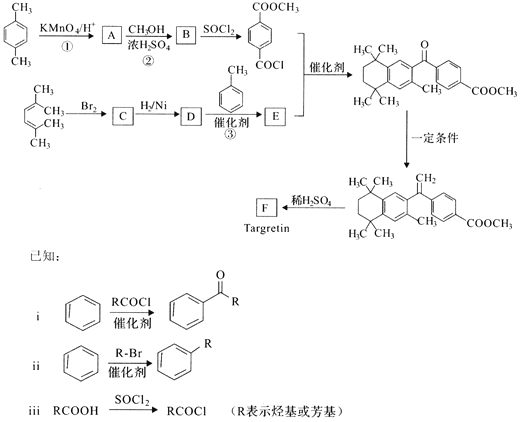
(1)反应①的反应类型是______________。
(2)反应②的化学方程式:__________________________________________。
(3)C的核磁共振氢谱图中有______________个峰。
(4)反应③的化学方程式:__________________________________________。
(5)F的分子式是C24H28O2. F中含有的官能团:__________________________。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构):_______________________________________________________________。
结构):_______________________________________________________________。
a.苯环上的一氯代物有两种 b.既能发生银镜反应又能发生水解反应
(7)已知:![]() 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
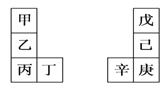
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.乙的单质在空气中燃烧生成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下:
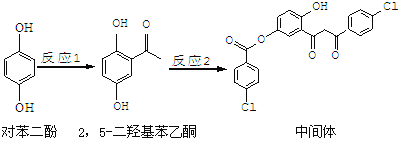
下列说法正确的是
A.对苯二酚和 互为同系物
互为同系物
B.1 mol该中间体最多可与7 mol氢氧化钠反应
C.2,5—二羟基苯乙酮能发生加成、水解等反应
D.该中间体分子含有羰基和羟基两种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(![]() )、肼(
)、肼(![]() )和四氧化二氧(
)和四氧化二氧(![]() )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知:![]()
![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式(![]() 用含
用含![]() 、
、![]() 、
、![]() 的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
的代数式表示)__________。该反应______(填“是”或“不是”)自发反应,判断的理由是_______。
(2)肼(![]() )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________。
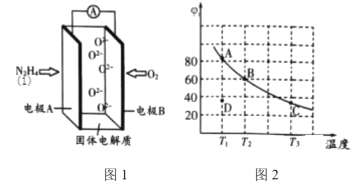
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(![]() )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________点。![]() 时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的
时,N2O4的平衡转化率为________;若达平衡时间为5 s,则此时间内的![]() 平均反应速率为________。
平均反应速率为________。
③若其条件不变,在![]() 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量![]() ,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
,达到新平衡时,与原平衡相比,NO2的体积分数________(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A.MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓B.CO2 + 2NaOH == Na2CO3 + H2O
C.CaCO3 ![]() CaO + CO2↑D.H2 + CuO ==H2O + Cu
CaO + CO2↑D.H2 + CuO ==H2O + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
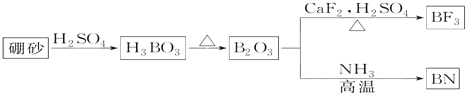
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式是___、___。
(2)基态B原子的电子排布式为___;B和N相比,非金属性较强的是___,BN中B元素的化合价为___;
(3)在BF3分子中,F﹣B﹣F的键角是___,该分子为___分子(填写“极性” 或“非极性”),BF3和过量NaF作用可生成NaBF4,BF4-中可能含有___,立体结构为___;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++S![]() +H++OH-BaSO4↓+H2O
+H++OH-BaSO4↓+H2O
B.刻制印刷电路板的反应:Fe3++CuFe2++Cu2+
C.氯气与氢氧化钠溶液反应:Cl2+2OH-Cl-+ClO-+H2O
D.稀硫酸滴到铁片上:2Fe+6H+2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:
![]()
(1)上述物质中为红棕色气体的是____(填化学式);
(2)NH3溶于水所得溶液呈___(填“酸性”、 “碱性”或“中性” );
(3)配平NO2→HNO3的化学方程式:3NO2 +H2O = ___HNO3 + NO。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com