
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g二氧化硅晶体中含有2NA个硅氧键B.1molD2O中含有10NA个质子
C.12g金刚石中含有NA个碳碳键D.1mol石墨晶体中含有2NA个碳碳键
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
资料:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3— | V2O74— | VO43— |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是_________。
(2)酸浸:①Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是________。
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____________。
②已知常温下CaCO3的溶度积常数为Ksp1,Ca3(VO4)2溶度积常数为Ksp2。过滤后的(NH4)3VO4溶液中VO43—的浓度为cmol/L,该溶液中CO32—的浓度为_______mol/L
③向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是_______________。
(4)测定产品中V2O5的纯度:称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol/L(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O)最后用c2mol/LKMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。
已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是_____。(V2O5的摩尔质量:182g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。
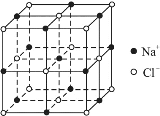
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关说法正确的是( )
A.![]() 分子中仅含极性共价键
分子中仅含极性共价键
B.钢管被原油中的含硫化合物腐蚀属于化学腐蚀
C.乙酸与用18O标记的乙醇反应得到的有机产物为C2H5O18OCCH3
D.NH4Br的电子式: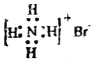
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表回答下列问题:
(1)写出元素Cu的基态原子的电子排布式:____________________。
(2)某元素A的核外价电子排布式为nsnnpn+1,该元素A原子核外最外层电子中成对电子共有________对。此元素A原子与O的第一电离能的相对大小为:A________ O(填“<”“>”或“=”)。
(3)元素C形成的最高价氧化物中含有________个π键。C和Cl形成化合物的电子式为_____________,此化合物中C的杂化方式为________。
(4)已知元素钒形成单质的晶胞如下图所示,则其原子的配位数是________,假设晶胞的边长为d cm、密度为ρ g·cm-3,则元素钒的相对原子质量为_____________ (NA为阿伏加德罗常数)。
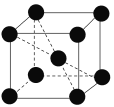
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质,1 3分】
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式______________。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是________(填化学式)。

(3)三氟化硼分子的空间构型是__________;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B—X键都当作单键考虑来计算键长,理论值与实测键长结果如下表。硼卤键长实测值比计算值要短得多,可能的原因是____________________________________________。

(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜【Cu2C12(CO)2·2H20】,其结构如图。

①该复合物中Cl原子的杂化类型为_______________。
②该复合物中的配位体有________________种。
(5)已知HF与Fˉ通过氢键结合成![]() 。判断
。判断![]() 和
和![]() 微粒间能否形成氢键,并说明理由。____________________________________。
微粒间能否形成氢键,并说明理由。____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电钠离子电池放电时工作原理如图所示,下列说法错误的是
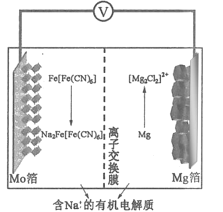
A.放电时电势较低的电极反应式为:Fe[Fe(CN)6]+2Na++2e-=Na2Fe[(CN)6]
B.外电路中通过0.2 mol电子的电量时,负极质量变化为2.4 g
C.充电时,Mo箔接电源的正极
D.放电时,Na+从右室移向左室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)是一种新型能源。
已知①CO(g)+2H2(g)CH3OH(g) H1=-99kJ/mol
②2CH3OH(g)CH3OCH3(g)+H2O(g) H2=-24kJ/mol
③CO(g)+H2O(g)CO2(g)+H2(g) H3=-41kJ/mol
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式:________________。
(2)下列措施能提高反应①中CO的平衡转化率的是________(填字母)。
A.增大压强 B.升高温度 C.增大H2浓度 D.加高效催化剂
(3)在恒温恒容条件下只发生反应③,下列情况表明该反应达到平衡的是________(填字母)。
A.气体压强保持不变 B.气体密度保持不变
C.![]() 保持不变 D.浓度商保持不变
保持不变 D.浓度商保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中投入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)的有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
[φ(CH3OCH3)] | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①30min时,CH3OH的转化率α(CH3OH)________%;该温度下,上述反应的平衡常数K=________(用分数表示)。
②反应速率v=v正-v逆,其中v正=k正φ2(CH3OH)、v逆=k逆φ(CH3OCH3)φ(H2O),k正、k逆分别为正、逆反应速率常数,只与温度有关,φ为物质的量分数。15min时![]() ________(结果保留2位小数)
________(结果保留2位小数)
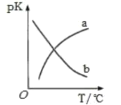
(5)在密闭容器中发生反应③,平衡常数为K,pK=-lg2K。pK温度的关系如图所示,图中曲线________(填“a”或“b”)能反映平衡常数变化趋势。
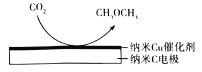
(6)在CO2处理过的饱和KHCO3溶液中,电解活化的CO2制备CH3OCH3的原理如图所示,阴极有HCO3-生成,该电的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com