
【题目】燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______g。
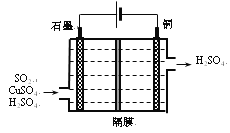
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______。
【答案】SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1 3 8 SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu CH4-8e-+10OH-=CO
+Cu CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
【解析】
根据题干要求书写热化学方式,运用盖斯定律计算放热;根据氧化还原反应中电子转移守恒进行相关计算;根据反应方程式及气体摩尔体积进行相关计算;根据电解质及燃料电池原理书写电极反应式。
(1)根据盖斯定律得:由I 2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH1=a kJ·mol-1;II H2S(g)=H2(g)+S(s) ΔH2=b kJ·mol-1; III H2O(l)=H2O(g) ΔH3=c kJ·mol-1;得I-2II+2III:SO2(g)+2H2(g)=S(s)+2H2O(g), ΔH=ΔH1-2ΔH1+2ΔH1=(a-2b+2c) kJ·mol—1,所以热化学方程式为:SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1,故答案为:SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1;
(2)该反应为氧化还原反应,根据电子得失守恒分析得: 硫元素得电子数目为:(+4-0)×1mol=4mol,ZnFe2O4中铁元素化合价为+3,ZnFe2Ox中铁元素化合价为x-1,铁元素失电子数目为[3-(x-1)]×4mol=4mol,则x=3:故答案为:3;
(3)①2SO2+ O2= 2SO3
44.8L 32g
11.2L m
解得m=8g;
②分析图中电解装置,可知左边石墨是电解池的阳极,右边是阴极;阳极放电的物质二氧化硫,失去电子生成硫酸根离子,电极反应式:SO2-2e-+2H2O=SO42-+2H+;阴极放电的物质时铜离子,得到电子被还原成单质铜,电极反应式:Cu2++2e-=Cu;将上述两电极的电极反应相加得:SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu;甲烷燃料电池中,甲烷为负极,失电子发生氧化反应,因为电解质呈碱性,则产物为碳酸根,负极反应式为:CH4-8e-+10OH-=CO
+Cu;甲烷燃料电池中,甲烷为负极,失电子发生氧化反应,因为电解质呈碱性,则产物为碳酸根,负极反应式为:CH4-8e-+10OH-=CO![]() ,故答案为:8; SO2+2H2O+Cu2+
,故答案为:8; SO2+2H2O+Cu2+![]() 4H++SO
4H++SO![]() +Cu;CH4-8e-+10OH-=CO
+Cu;CH4-8e-+10OH-=CO![]() 。
。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( )

A.能和碳酸氢钠溶液反应的官能团有2种
B.1 mol该有机物最多能与2 mol H2发生加成反应
C.与![]() 互为同分异构体
互为同分异构体
D.既可以发生取代反应又可以发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,下列说法正确的是

A. 该电池能在高温下工作
B. 该电池工作时,中间室中的Cl-移向右室
C. 正极上发生的电极反应:2NO3-+ 6H2O + 10e-═ N2 ↑+ 12OH-
D. 若有机废水中有机物用C6H12O6表示,每消耗1 mol C6H12O6 转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是__________。
(3)Cu2Cl22CO2H2O是一种配合物,其结构如图所示:
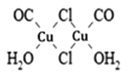
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。

a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:

若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2L酒精中含有分子的数目为0.5NA
B.常温常压下,3.2g18O2的中子数目为2NA
C.常温常压下,24g镁与足量盐酸充分反应,转移的电子数为2NA
D.常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】有机玻璃是一种高分子化合物,在工业上和生活中有着广泛用途,工业上合成有机玻璃流程为:

下列说法不正确的是
A. 反应①的原子利用率达100%
B. 反应②是加聚反应
C. 相对分子质量为86,且与甲基丙烯酸甲酯具有相同官能团的有机物有5种
D. 甲基丙烯酸甲酯能使酸性高锰酸钾褪色,也能使Br2/CCl4褪色,二者原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,密闭容器中充入一定物质的量的NO2 和SO2 ,发生如下反应: NO2+ SO2![]() NO + SO3 ,达到平衡时,下列叙述正确的是
NO + SO3 ,达到平衡时,下列叙述正确的是
A、 SO2 、NO2、NO、SO3 的物质的量一定相等
B、 NO2和 SO2 的物质的量一定相等
C、平衡体系中反应物的总物质的量一定等于生成物的总物质的量
D、NO 和 SO3 的物质的量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com