
| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
分析 A.溶于水后能电离出H+的化合物不一定为酸,如硫酸氢钠;
B.水溶液中或熔融状态下导电的化合物为电解质;
C.水溶液中或熔融状态下导电的化合物为电解质,水溶液中和熔融状态下都不导电的化合物为非电解质;
D.固体氯化钠中 不存在自由移动的离子,溶于水生成自由移动的离子,溶液导电.
解答 解:A.溶于水后能电离出H+的化合物不一定为酸,如硫酸氢钠,而电离出的阳离子全部为H+的化合物就是酸,故A错误;
B.硫酸钡在溶液中溶解的完全电离,熔融状态完全电离属于强电解质,故B错误;
C.二氧化碳不能电离属于非电解质,溶于水导电是因为二氧化碳和水反应生成了电解质碳酸,故C错误;
D.固体NaCl中不存在自由电子或者自由移动的离子,但是在水溶液里或熔融状态下能导电,是电解质,故D正确;
故选D.
点评 本题考查了电解质的判断和物质导电的条件,注意电解质必须是化合物,注意知识积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=1 mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 还原性:Fe2+>I->Cl- | |
| C. | FeCl3能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 反应①中只体现盐酸的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
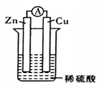
| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| B. | 若△H>0,△S<0,任何温度下都不能自发进行 | |
| C. | 需要加热才能够进行的过程肯定不是自发过程 | |
| D. | 非自发过程在一定条件下可能变成自发过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com