
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热,依据热化学方程式和盖斯定律计算得到所需热化学方程式;
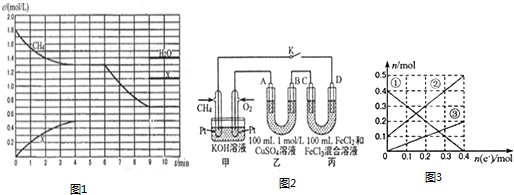
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
结合温度对反应速率的影响来解答.
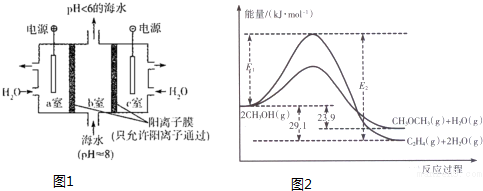
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,根据电子转移守恒计算生成气体的物质的量,进而计算氧气的体积;
③C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
解答 解:(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=1076kJ/mol+2×458.5kJ/mol-2×799kJ/mol-436kJ/mol=-41kJ/mol;
由①C(s)+H2O(g)?CO(g)+H2(g)△H1=+131.3kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ/mol
③C(s)+2H2(g)?CH4(g)△H3=-74.8kJ•mol-1
结合盖斯定律③-①-②得到CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H4,则△H4=-165.1kJ/mol,
故答案为:-41kJ/mol;-165.1kJ/mol;
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
①0~4min内,H2的平均反应速率υ(H2)=$\frac{2mol/L}{4min}$=0.5mol•L-1•min-1,
故答案为:0.5;
②反应在5min时的平衡常数K=$\frac{0.5×{2}^{4}}{1.3×2.{6}^{2}}$=0.91,
故答案为:0.91;
③根据图象第6 min~9 min时的反应速率比0~4 min时的大,且平衡向正反应方向移动,说明第6 min改变的条件为升高温度或增加水蒸气的量,再根据第9 min平衡时甲烷浓度为0.7 mol/L,水蒸气浓度为1.4 mol/L,说明甲烷消耗1.1 mol,水蒸气消耗2.2 mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度,
故答案为:升高温度;
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:正;CH4-8e-+10OH-=CO32-+7H2O;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,析出Cu的物质的量为0.1L×1mol/L=0.1mol,设氧气、氢气的物质的量均为n mol,根据电子转移守恒:4n=2n+0.1×2,解得n=0.1,故A极析出的氧气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
③根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据②计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,原溶液中有Fe2+ 0.1mol,所以原溶液中c(Fe2+)=$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:Cu2+;1mol/L.
点评 本题综合性较大,题目涉及燃料电池、电解原理的应用、离子浓度大小比较、电极反应式书写以及据电极反应式的计算,盖斯定律计算和热化学方程式书写方法,题目难度中等,注意把握原电池和电解质中电极方程式的书写以及电子守恒在计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
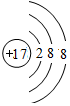 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.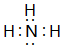 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为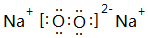 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
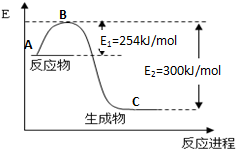 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com