
| 5.6L |
| 22.4L/mol |
| 80×0.3 |
| 30.4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO+CuO
| ||||
| B、2FeCl2+Cl2=2FeCl3 | ||||
| C、CaO+H2O=Ca(OH)2 | ||||
| D、2Al+3CuSO4=3Cu+2Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度盐酸所用的0.05mol/L NaOH溶液,在配制标准液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往洗净的滴定管中,直接加入标准液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
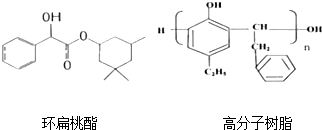
查看答案和解析>>
科目:高中化学 来源: 题型:
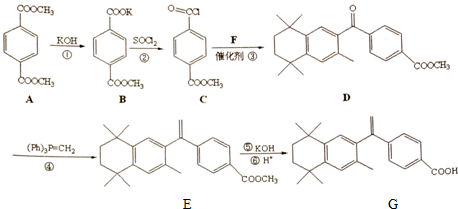
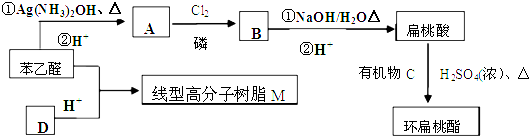
 ,则不含苯环的有机产物的结构简式为
,则不含苯环的有机产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
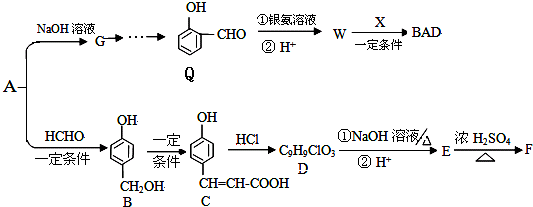
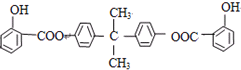
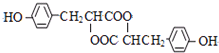
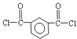 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式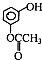
查看答案和解析>>
科目:高中化学 来源: 题型:
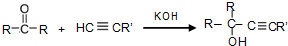
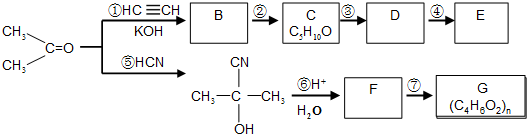
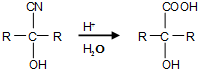
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com