
【题目】一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃可能是( )
A.乙烷和丙烯B.甲烷和丙烯C.甲烷和乙烯D.乙烷和乙烯
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的价电子排布式为3d64s2;Z原子的![]() 电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2Q3
B.X与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
![]() 元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
![]() 三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
![]() 自然界中,含B的钠盐是一种天然矿藏,其化学式写作
自然界中,含B的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“
,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“![]() ”标出其中的配位键,该阴离子通过______相互结合形成链状结构。
”标出其中的配位键,该阴离子通过______相互结合形成链状结构。

![]() 科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
![]() 磷化硼
磷化硼![]() 是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为 ,下列说法正确的是
,下列说法正确的是
A. 羊毛与该聚酯纤维的化学成分相同
B. 该聚酯纤维和羊毛在一定条件下均不能水解
C. 由单体合成该聚酯纤维的反应属于加聚反应
D. 合成该聚酯纤维的单体为对苯二甲酸和乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是( )
A.用醋酸除去水垢: CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
B.二氧化锰与浓盐酸反应制氯气: MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.碳酸钠溶液呈碱性: CO![]() +H2O
+H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵两稀溶液混合:Ba2++2OH-+NH![]() +HCO
+HCO![]() = BaCO3↓+NH3·H2O+H2O
= BaCO3↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图1、图2、图3及题中信息,回答下列问题
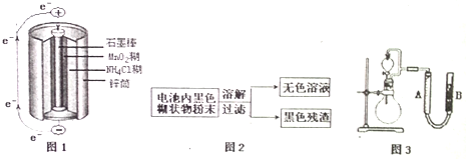
![]() 图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时
图1是锌锰干电池基本构造图,该电池的负极材料是 ______ ;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______ ;当电路中每通过
的微粒,正极的电极反应式是 ______ ;当电路中每通过![]() ,负极质量减少 ______ ;
,负极质量减少 ______ ;
![]() 图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣
图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣![]() 的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有 ______ ;
![]() 图3是探究
图3是探究![]() 在制
在制![]() 过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表
过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表![]() 已知:两次实验气体的体积在相同条件下测定:
已知:两次实验气体的体积在相同条件下测定:![]() 由分液漏斗滴入到圆底烧瓶
由分液漏斗滴入到圆底烧瓶![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
实验一 | 足量 |
|
|
实验二 |
|
|
|
![]() 在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
在测量气体体积时,除要注意待气体温度恢复至室温、平视度数外,还需要注意 ______ ;
![]() 实验一、二中参加反应的
实验一、二中参加反应的![]() 的物质的量之比为 ______ 。
的物质的量之比为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com