
【题目】甲是短周期元素中原子半径最小的元素,乙的气态氢化物的水溶液显碱性,丙是短周期元素中原子半径最大的元素,丁是地壳中含量最多的金属元素。
(1)写出四种元素的名称:甲______,乙______,丙______,丁______。
(2)乙、丙、丁三种元素的原子半径从大到小的顺序是________(填元素符号,下同)![]() ________
________![]() ________。
________。
(3)写出乙、丙、丁的最高价氧化物对应的水化物相互反应的化学方程式:__________________、__________________、__________________。
【答案】氢 氮 钠 铝 ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
甲是短周期元素中原子半径最小的元素,则甲是氢;乙的气态氢化物的水溶液显碱性,则乙是氮;丙是短周期元素中原子半径最大的元素,则丙是钠;丁是地壳中含量最多的金属元素,则丁是铝,据此解答。
甲是短周期元素中原子半径最小的元素,则甲是氢;乙的气态氢化物的水溶液显碱性,则乙是氮;丙是短周期元素中原子半径最大的元素,则丙是钠;丁是地壳中含量最多的金属元素,则丁是铝;
(1)由分析可知,甲是氢,乙是氮,丙是钠,丁是铝;
(2)同周期元素从左向右,原子半径逐渐减小,一般电子层数越多,原子半径越大,则原子半径:![]() ;
;
(3)乙、丙、丁的最高价氧化物对应的水化物分别为:HNO3、NaOH、Al(OH)3,两者相互反应的化学方程式为:![]() 、
、![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>X>Y>Z
C.工业上用电解法冶炼Z单质
D.元素Q的含氧酸的酸性一定比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2=LiMnO2,下列说法正确的是( )
A.锂是正极,电极反应为:Li-e-=Li+B.锂是负极,电极反应为:Li-e-=Li+
C.锂是负极,电极反应为:MnO2+e-=MnO![]() D.锂是负极,电极反应为:Li-2e-=Li2+
D.锂是负极,电极反应为:Li-2e-=Li2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同周期的![]() 、
、![]() 、
、![]() 三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为
三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.三种元素的原子序数按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
B.单质的氧化性按![]() 、
、![]() 、
、![]() 的顺序减弱
的顺序减弱
C.原子半径按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
D.气态氢化物的稳定性按![]() 、
、![]() 、
、![]() 的顺序增强
的顺序增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑦在周期表中的相对位置如图所示。
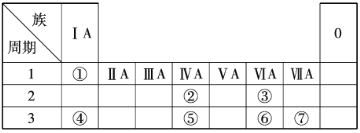
请回答下列问题。
(1)⑤的元素符号是____________,其最高正化合价是____________。
(2)①~⑦中金属性最强的是____________(填元素符号),能证明⑥比②的非金属性强的事实是____。
(3)③④形成的化合物是____________或____________。
(4)④⑥⑦原子半径由大到小的顺序是__________________(用元素符号表示);④的最高价氧化物对应的水化物是____________,它与⑥的最高价氧化物对应的水化物反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于核电荷数为![]() 的元素,下列有关元素性质与原子结构的理解正确的是( )
的元素,下列有关元素性质与原子结构的理解正确的是( )
A.原子最外层电子数小于4的元素一定是金属元素
B.原子最外层电子数大于4的元素一定是非金属元素
C.原子最外层电子数与该元素的常见化合价的绝对值一定相等
D.原子最外层电子数与其电子层数相等的元素一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)E的价电子排布式是_____,A、B、C、D的第一电离能由小到大的顺序_____。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是__________;
(3)D的低价氧化物分子的空间构型是_______。
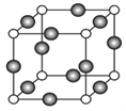
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为_______________;(每个球均表示1个原子,白球为A,黑球为E) 若相邻A原子和E原子间的距离为a nm,阿伏加德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
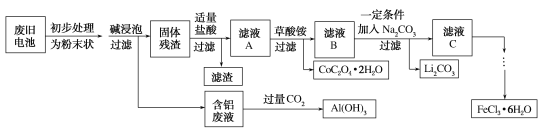
已知:还原性:Cl>Co2+;
回答下列问题:
(1)废旧电池初步处理为粉末状的目的是___________。
(2)从含铝废液得到Al(OH)3的离子方程式为________。
(3)滤液A中的溶质除HCl、LiCl外还有FeCl3、CoCl2。写出LiCoO2和盐酸反应的化学方程式_______。
(4)滤渣的主要成分为______(填化学式)。
(5)已知Li2CO3的溶度积常数Ksp=8.64×104,将浓度为0.02mol·L1的Li2SO4和浓度为0.02 mol·L1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L1。
(6)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为![]()
B.与甲烷、乙烯相比,苯的独特性质具体来说是易取代,能加成,难氧化
C.除去乙烷中混有的乙烯,应在一定条件下通入氢气,使乙烯转化为乙烷
D.某有机物的结构简式为![]() ,其分子结构中处在同平面内的原子最多有15个
,其分子结构中处在同平面内的原子最多有15个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com