
【题目】已知同周期的![]() 、
、![]() 、
、![]() 三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为
三种元素的最高价氧化物的水化物的酸性由强到弱的顺序为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.三种元素的原子序数按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
B.单质的氧化性按![]() 、
、![]() 、
、![]() 的顺序减弱
的顺序减弱
C.原子半径按![]() 、
、![]() 、
、![]() 的顺序增大
的顺序增大
D.气态氢化物的稳定性按![]() 、
、![]() 、
、![]() 的顺序增强
的顺序增强
【答案】D
【解析】
由三种元素最高价氧化物的水化物的化学式可知,X、Y、Z的最高化合价分别为+5、+6、+7,它们分别处在同一周期的ⅤA族、ⅥA族、ⅦA族,故三种元素的原子序数:X<Y<Z,据此分析。
由三种元素最高价氧化物的水化物的化学式可知,X、Y、Z的最高化合价分别为+5、+6、+7,它们分别处在同一周期的ⅤA族、ⅥA族、ⅦA族,故三种元素的原子序数:X<Y<Z;
A.由分析可知,原子序数:X<Y<Z,故A错误;
B.同周期主族元素单质氧化性逐渐增强,故单质的氧化性:X<Y<Z,故B错误;
C.同周期主族元素从左往右原子半径逐渐减小,故原子半径:X>Y>Z,故C错误;
D.元素非金属性越强,气态氢化物的稳定性越强,故气态氢化物的稳定性:X<Y<Z,故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】实验室模拟工业生产食品香精菠萝酯(![]() )的简易流程如图:
)的简易流程如图:
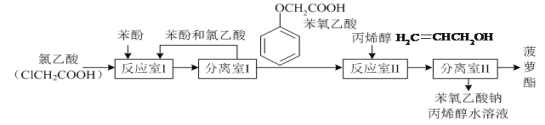
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用________(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热.
(2)分离室I采取的操作名称是__________。
(3)苯氧乙酸含氧官能团的名称__________。
(4)下列叙述错误的是_________。
A.反应室I产物中残留的苯酚可用FeCl3溶液检验
B.反应室Ⅱ产物中残留的丙烯醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
(5)反应室I中发生反应的化学方程式是______。
(6)分离室Ⅱ的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.7.8g苯所含碳碳双键数目为0.3NAB.28g乙烯所含共用电子对数目为5NA
C.标准状况下,11.2L乙醇所含分子数为0.5NAD.16g甲烷电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。

(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是___。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式:___,该反应作氧化剂的物质是__。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH2
若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=___。
(3)有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
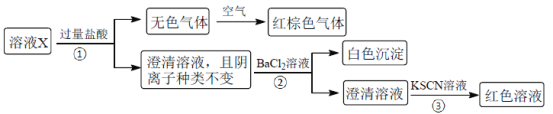
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是短周期元素中原子半径最小的元素,乙的气态氢化物的水溶液显碱性,丙是短周期元素中原子半径最大的元素,丁是地壳中含量最多的金属元素。
(1)写出四种元素的名称:甲______,乙______,丙______,丁______。
(2)乙、丙、丁三种元素的原子半径从大到小的顺序是________(填元素符号,下同)![]() ________
________![]() ________。
________。
(3)写出乙、丙、丁的最高价氧化物对应的水化物相互反应的化学方程式:__________________、__________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源开发前景十分广阔。海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。则下列说法不正确的是

A.t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
B.t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和
C.t2℃时,KCl和MgSO4两种物质的溶解度相同
D.将卤水加热到t2℃ 以上,析出的晶体主要为MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①离子化合物中一定有离子键,一定没有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③共价化合物中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①②⑥B.①③④⑥C.②③⑥D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com