
【题目】工业上常用电解铬酐(CrO3,遇水生成H2Cr2O7和H2CrO4)水溶液的方法镀铬,电镀液中需加入适量的催化剂和添加剂,并通过加入H2O2提高或降低电镀液中Cr(Ⅲ)的含量,发生的部分反应有:
①Cr2O72-+14H++6e=2Cr3++7H2O
②2H++2e=H2
③2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
④CrO42-+8H++6e=Cr+4H2O
⑤2H2O4e=O2+4H+
⑥2Cr3++7H2O6e=Cr2O72-+14H+
下列说法错误的是( )
A.反应①②在镀件上发生
B.H2O2既体现氧化性又体现还原性
C.当镀件上析出52g单质铬时,电路中转移6mol电子
D.电镀一段时间后,电极附近溶液的pH:阳极>阴极
科目:高中化学 来源: 题型:
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化合物A由两种元素组成,可以发生如下的转化。
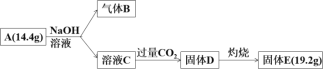
已知:标准状况下,气体B的密度是氢气的8倍。请回答:
(1)组成A的元素有_________,A的化学式是_________
(2)请写出A与NaOH溶液反应的化学方程式_________
(3)A可用于金属的冶炼,请写出A与Fe2O3的化学反应方程式_________
Ⅱ.某实验小组做了如下实验:

请回答:
(1)写出硬质管中发生反应的化学方程式:_________
(2)有同学认为乙醇的催化氧化反应产物中含有乙酸,请设计实验检验产物成分:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、水煤气、甲醇、乙醇等都是重要的化工原料。
(1)水煤气生产原理是:C(s)+H2O(g) ![]() CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
CO(g)+ H2(g) ΔH = +131.3kJ·mol-1。
①能说明该反应达到平衡状态的是______(填字母)。
A.v正(CO)= v正(H2) B.c(CO)=c(H2)
C.恒容容器中,气体密度不变 D.恒容容器中,气体压强不变
②该反应达到化学平衡时,若要增大水蒸气的转化率可采取的措施是____(填字母)。
A.增加碳的物质的量 B.增加水蒸气的物质的量
C.增大压强 D.升高温度
(2)已知:CO(g)+ 2H2 (g)![]() CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
CH3OH(g)。等物质的量的 CO与H2在催化剂作用下反应生成甲醇,平衡后若将容器的容积压缩为原来的一半(其他条件不变),对平衡体系产生的影响是______(填字母)。
A.c( H2 )减少 B.CH3OH 的物质的量增加 C.重新平衡时![]() 减小
减小
(3)已知6H2(g)+2CO2(g) ![]() CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
CH3CH2OH(g)+3H2O(g) 。在温度为T℃,容积不变的密闭容器中,将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数为a。
①达到平衡时,转化率α(H2):α(CO2) = ______。
②恒容下,再向该容器中充入2mol He,则H2的转化率______(填“增大” 、“减小” 或“不变”)。
③在T℃,容积可变的密闭容器中将3mol H2和1mol CO2混合,达到平衡时CO2气体的体积分数_______a(填“>” 、“<” 或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图![]()
D. Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是![]()
![]()
A. ![]() 为直线形分子,
为直线形分子,![]() 也为直线形分子
也为直线形分子
B. 固态![]() 是分子晶体,固态
是分子晶体,固态![]() 也是分子晶体
也是分子晶体
C. ![]() 中N原子是
中N原子是![]() 杂化,
杂化,![]() 中B原子也是
中B原子也是![]() 杂化
杂化
D. ![]() 能溶于NaOH溶液,
能溶于NaOH溶液,![]() 也能溶于NaOH溶液
也能溶于NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若要完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3的体积比为1:1:1,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组需要1 molL﹣1的CuSO4 溶液80 mL,现用胆矾(CuSO4·5H2O)来配制,请回答下列问题:
(1)需称取胆矾 ______g。
(2)配制过程中,不需要的仪器(填序号)________。
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.蒸发皿
完成配制实验还缺少的仪器是________。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有_____(填序号)。
①转移前,容量瓶中含有少量蒸馏水 ②转移时有少量液体溅出
③定容时,俯视刻度线 ④颠倒摇匀后发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com