
����Ŀ��2SO2��g��+O2��g��![]() 2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ų�����99kJ����ش��������⣺
2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ų�����99kJ����ش��������⣺
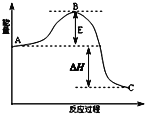
��1��ͼ��A��C�ֱ��ʾ_____________��_____________��
��2���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B��_________����������������������������H_______����������������� С����������������������______________________��
��3��ͼ�С�H=________kJ/mol��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���ƣ�2Na2CO3��H2O2������������˫��ˮ������Na2CO3��H2O2˫�����ʣ���������Ư����������һ������˫��ˮ�ʹ������ȶ����������Ʊ���̼���ƵĹ������ȶ�������ͼ����֪��2Na2CO3��3H2O2![]() 2Na2CO3��3H2O2
2Na2CO3��3H2O2

����˵������ȷ����
A.FeCl3��Һ�ɼ��ٹ�̼���Ƶ�ʧЧ
B.����NaCl�������ǽ���2Na2CO3��3H2O2���ܽ�ȣ����������ྦྷ��
C.������̼���Ƶ���������©�˾����ϴ��һ�������²�Ʒ���Ƚ���
D.�����������п�ѭ��ʹ�õ�������CO2��NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������A��B��C����ͼ��ʾ��ת����ϵ������H=��H1+��H2����������ת����ϵ��A��C������
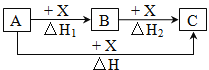
��Fe��FeCl3��C��CO2��AlCl3��NaAlO2��NaOH��NaHCO3��S��SO3��Na2CO3��CO2
A.ֻ���ڢۢܢ�B.������C.������D.ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�á�Ϊ̽�����������ʣ�ijͬѧ�������ͼ1��ʾ��ʵ��װ�á�
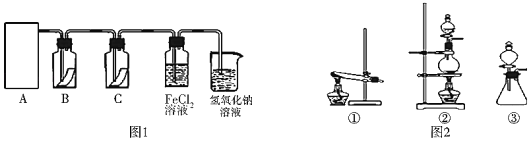
��1��ʵ������ȡ�����ķ�Ӧԭ��Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O���÷�Ӧ�л�ԭ����_____����ԭ������_____
MnCl2+Cl2��+2H2O���÷�Ӧ�л�ԭ����_____����ԭ������_____
��2�����ã�1��������ԭ������ͼ2��ѡ����ʵ�����װ�ã�A������_____����д��ţ���
��3��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������������װ��_____�еĺ�ɫ������ɫ����ʵ������и�ͬѧ����װ��B��C�еIJ�������ɫ����ԭ�������_____��˵����װ�ô������Ե�ȱ�ݣ�����������ĸĽ�����_____
��4��Ϊ����֤�����������ԣ�������ͨ��FeCl2��Һ�У�д��������FeCl2��Һ��Ӧ�����ӷ���ʽ_____
��5����ҵ�ϳ���ʯ����������������β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���_____���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ȡŨ�Ⱦ�Ϊ0.1molL-1�Ĵ�����Һ�Ͱ�ˮ��Һ��20mL���ֱ���0.1molL-1NaOH��Һ��0.1molL-1��������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ��ͼ��ʾ������˵����ȷ����
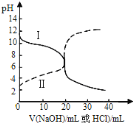
A.���ߢμ���Һ��10mLʱ![]()
B.���ߢμ���Һ��20mLʱ��![]()
C.���ݵζ�����,�ɵ�![]()
D.�����ߢ��֪,ѡ�÷�̪��ѡ�ü�����ָʾ��������NaOH��Һ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.7g����4.6g��ͬʱ����������ˮ�г�ַ�Ӧ������Ӧ�����Һϡ�͡�����Ϊ500mL������˵������ȷ���ǣ� ��
A. ��Ӧ�зų��������ڱ�״���µ����Ϊ2.24 L
B. �μӷ�Ӧ��ˮ����������������������
C. ������Һ�������Ӻ����������ʵ���֮��Ϊ2��1
D. ������Һ�������Ӻ������ӵ����ʵ���֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����������һ�������¾�����ͼ��ʾ��ת����ϵ�������ж���ȷ����
![]()
A. ��ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ����X������NaAlO2
B. ��ͼ�з�Ӧ��Ϊ��������ԭ��Ӧ����WΪһԪǿ��ʱ����X������NH3
C. ��ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ�ǽ�������ʱ����Z������CO2
D. ��ͼ�з�Ӧ��Ϊ������ԭ��Ӧ����WΪ��������ʱ����Z������FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ƣ�Na2S2O4)�׳Ʊ��շۣ�������ʳƷ���ʼ�����ֱ�Ӽ���ʳƷ�У���ȫ������������������ֽ���������ȵ�Ư����Na2S2O4������ˮ���������Ҵ����ڼ��Խ����н��ȶ����ڿ������ױ��������ش��������⣺
(1)Na2S2O4���ڱ��ʼ�ʱ��ȥ��O2��������Na2SO3�������ͷ�SO2���÷�Ӧ�Ļ�ѧ����ʽΪ________��
(2)п�۷��Ʊ�Na2S2O4�Ĺ���������ͼ��ʾ��
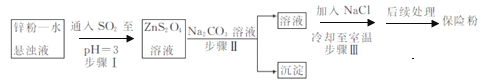
��ʵ���ҿ���Ũ������������Ʒ�Ӧ��ȡSO2����ϣ���ܿ��Ʒ�Ӧ�ٶȣ�ͼ�п�ѡ�õķ���װ����________������ĸ����
�ڹ�ҵ�ϳ���п�����Ԥ�����õ�п�ۡ�ˮ����Һ����Ŀ����_______��������з�����Ӧ�Ļ�ѧ����ʽΪ___��
���ڲ���.�еõ���Na2S2O4����Ҫ���Ҵ�ϴ�ӣ����ŵ���_______��
(3)Ŀǰ���ҹ��ձ���ü����Ʒ����������������ƣ���ԭ�����Ƚ�HCOONa���ռ������ ��ˮ��ҺҺ�У�Ȼ��ͨ��SO2������Ӧ����CO2����ų����ܷ�Ӧ�Ļ�ѧ����ʽ��___________��
(4)�����������Ƶķ�����⡣���軯�ط������軯��K3[Fe(CN)6]��һ�ֱȽ������������������ǿ��������û�е�ѡ���������ԣ��ܽ�S2O42-����ΪSO32-��[Fe(CN)6]3-��ԭΪ[Fe(CN)6]4-��ȡ50.00mLNa2S2O4��Ʒ��Һ����0.02molL-1��K3[Fe(CN)6]��Һ�ζ����յ㣬����10.00mL������Ʒ��Na2S2O4�ĺ���Ϊ_______gL-1��(��SO2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�ֳ���Ԫ����ɵĻ�����G���й�ת����ʵ����Ϣ���£�
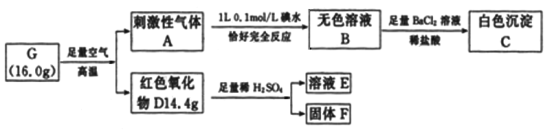
��ش��������⣺
(1)G��______________���ѧʽ����
(2)д��A��B�����ӷ���ʽ_____________________________________________��
(3)��DΪ�����F�Ǻ�ɫ�������ʣ�д��D��ϡ���ᷴӦ�����ӷ���ʽ_____________��
(4)C���������Ϊ________________g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com