
【题目】一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是
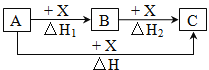
①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2
A.只有②③④⑥B.除①外C.除⑤外D.全部
【答案】A
【解析】
①Fe在氯气中燃烧生成FeCl3,不存在上述转化,故①不选;②为C在少量氧气中燃烧生成CO,CO继续在氧气中燃烧生成CO2,C可在足量氧气中燃烧生成CO2,符合,故②选;③为AlCl3与少量NaOH溶液反应生成Al(OH)3 ,继续滴加过量NaOH溶液则生成NaAlO2的转化,AlCl3与过量NaOH溶液作用可直接生成NaAlO2,符合,故③选;④为NaOH与CO2反应生成Na2CO3,继续通入CO2则生成NaHCO3,NaOH溶液里通足量CO2可直接生成NaHCO3,故④选;⑤S与氧气不能反应生成SO3,不符合A、X的转化,故⑤不选;⑥为Na2CO3溶液中滴加少量HCl可生成NaHCO3 ,继续滴加过量HCl,可生成CO2的转化,Na2CO3与过量稀盐酸作用生成CO2,符合转化关系,故⑥选;
只有②③④⑥正确,故答案为A。


科目:高中化学 来源: 题型:
【题目】某新型锂空气二次电池放电情况如图所示,关于该电池的叙述正确的是
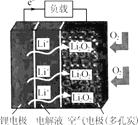
A.电解液应选择可传递Li+的水溶液
B.充电时,应将锂电极与电源正极相连
C.放电时,空气电极上发生的电极反应为 2Li++O2+2e-=Li2O2
D.充电时,若电路中转移0.5mol电子,空气电极的质量将减少3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物甲的结构简式为:![]() ,它可以通过下列路线合成(分离方法和其他产物已经略去);已知-NH2显碱性,且易被氧化,同时可以和-COOH脱水缩合形成肽键(
,它可以通过下列路线合成(分离方法和其他产物已经略去);已知-NH2显碱性,且易被氧化,同时可以和-COOH脱水缩合形成肽键(![]() )。
)。
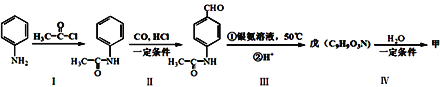
下列说法不正确的是
A. 甲可以发生取代反应、加成反应
B. 步骤I的反应方程式是: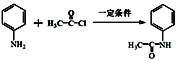
C. 戊分子中含有的官能团只有两种
D. 步骤I和IV在合成甲过程中的目的是保护氨基不被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国本土科学家屠呦呦凭借发现抗疟特效药青蒿素,赢得了2015年度诺贝尔生理学奖.青蒿素的发明不仅治愈了众多疟疾患者,更为中医药走出国门开创了先河.青蒿素的一种化学合成部分工艺流程如下:
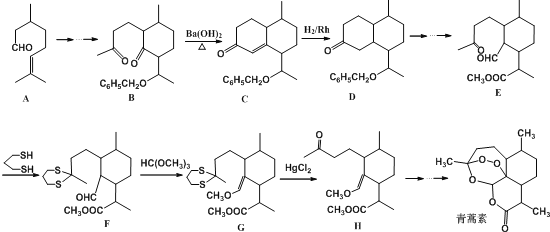
由青蒿素还可以合成药效增强的系列衍生物
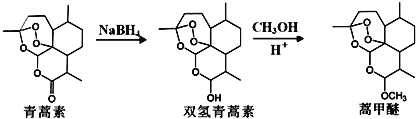
(1)青蒿素分子中含有的含氧官能团有: ______ 、 ______ 和过氧基.双氢青蒿素分子结构中有若干个六元环和七元环组成,其中含有七元环数为 ______ .蒿甲醚的化学式为 ______ .
(2)反应B→C,实际上可看作两步进行,依次发生的反应类型是 ______ 、消去反应.
(3)合成路线中设计E→F、G→H的目的是 ______ .
(4)A在Sn-β沸石作用下,可异构为异蒲勒醇![]() ,则异蒲勒醇分子有 ______ 个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成
,则异蒲勒醇分子有 ______ 个手性碳原子(连有四种不同原子或原子团的碳原子称为手性碳原子).异蒲勒醇可通过两步反应生成![]() ,请写出相关化学反应方程式 ______ , ______ .
,请写出相关化学反应方程式 ______ , ______ .
(5)写出与A互为同分异构体,且满足以下条件的同分异构体数目为 ______ 种(不考虑空间异构).其中核磁共振氢谱有七个峰,且峰面积比为1:1:4:4:1:1:6的是: ______ .(填结构简式)
①分子中只含有一个六元环,
②六元环上只有二个取代基且在不同的碳原子上
③能够发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1 ____ΔH2(填“>”、“<”或“=”,下同)。
(2)相同条件下,1 mol氮气和氢气反应断键吸收能量____形成2 mol氨气成键所放出的能量。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1___ΔH2。①P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1, ②4P(红磷,s)+5O2(g)= 2P2O5(s) ΔH2。
(4)25℃ 1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36 kJ热量,该反应的热化学方程式是_______。
(5)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是_______。
(6)已知:C(s)+O2(g)=CO2(g) △H=-437.3kJmol﹣1,H2(g)+![]() O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+
O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰) Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
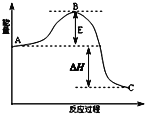
(1)图中A、C分别表示_____________、_____________.
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点_________(填“升高”,“降低”),△H_______(填“变大”,“变 小”或“不变”),理由是______________________.
(3)图中△H=________kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为_____检验溶液中还有Fe3+的试剂是_____
(2)工业上制取漂白粉的化学反应方程式为_____除去氯气中混有的氯化氢气体的方法是将气体通过_____溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_____
(4)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com