
【题目】下列有关叙述正确的是( )
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B.同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C.配制450mL0.1molL-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L0.45molL-1NaCl溶液中Cl-的物质的量浓度比0.1L0.1 molL-1AlCl3溶液大
【答案】BD
【解析】
A.质量相等的CO和CO2的物质的量分别是![]() 、
、![]() ,它们所含的氧原子数目之比为(
,它们所含的氧原子数目之比为(![]() ×1):(
×1):( ![]() ×2)=11:14,故A错误;
×2)=11:14,故A错误;
B. 同体积、同密度的C2H4和CO,质量一定相同,则C2H4和CO的物质的量分别是![]() 、
、![]() ,所以两种气体的分子数一定相等,故B正确;
,所以两种气体的分子数一定相等,故B正确;
C. 配制450mL0.1molL-1的NaOH溶液,需用500 mL容量瓶,需取NaOH固体的质量是0.5L×0.1molL-1×40g/mol=2.0g,故C错误;
D. 1L0.45molL-1NaCl溶液中Cl-的物质的量浓度是0.45molL-1, 0.1L0.1 molL-1AlCl3溶液中Cl-的物质的量浓度是0.3molL-1,故D正确;
答案选BD。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是( )
A.氢氧化镁与稀硫酸反应:![]()
B.用饱和氯化铁溶液制取氢氧化铁胶体:![]()
C.石灰乳与碳酸钠溶液反应:![]()
D.向NaHSO4溶液中滴加Ba(OH)2溶液至刚好沉淀完全:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中不正确的是
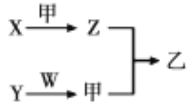
A. 沸点:W>X
B. 原子半径:D>B>C>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物既可以是离子化合物,又可以是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g18O形成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个
C.0.2 mol18O2气体的体积约为4.48 L
D.18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
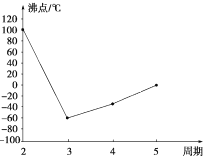
(1)写出F元素基态原子的核外电子排布式:____________。
(2)B、C、D三种元素电负性由大到小的顺序是____________(用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________(填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________,1 mol B2A4分子中含有________个σ键;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氧化铜与稀盐酸混合:CuO+2H+=Cu2++H2O
B.稀硫酸与氢氧化钡溶液混合:SO![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
C.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH
+OH![]() =CaCO3↓+H2O
=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g); C(s)+![]() O2(g)===CO(g)
O2(g)===CO(g)
②S(s)+O2(g)===SO2(g); S(g)+O2(g)===SO2(g)
③H2(g)+![]() O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
④2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl (aq)===NaCl (aq)+H2O(l); NaOH(aq)+HF(aq)===NaF(aq)+H2O(l)
A. ①③⑤B. ②④⑤C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子,某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验Ⅰ.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为:____。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点,并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol·L-1的稀H2SO4,关闭活塞。
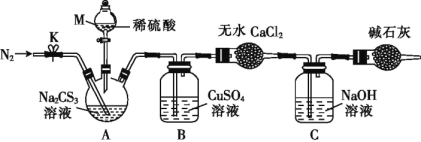
已知:CS32- +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为____。
(5)B中发生反应的离子方程式为:____。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com