
| �� |
| ||
| ||
| ||
| �� |
| ||
| �� |


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
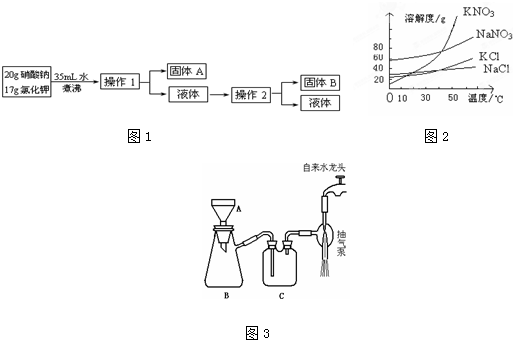
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������������Ͱ�ˮ�Ļ��Һ |
| B��ˮ�������c��OH-��=1��10-3mol?L-1����Һ |
| C��80��ʱ���Ȼ�����Һ |
| D��c��H+��=1��10-3mol?L-1������c��OH-��=1��10-3mol?L-1�ļ��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ����SO42-��Cl- |
| B��һ����SO42-��Al3+ |
| C�����ܺ���Al3+��Na+ |
| D��һ��û��CO32-��Cl-��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | �� | �� | �� |
| �Ͻ����� | 0.390g | 0.702g | 0.936g |
| ������������ | 448mL | 672mL | 672mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ƹ����������ڶƼ��������� |
| B�����ʱ��Һ��Cu2+�������������������Ϸ�����ԭ��Ӧ |
| C��������ӦʽΪHCHO+3OH--2e-=2H2O+HCOO- |
| D�����ʱÿ����6.4gͭ���Ʋ�ų�2.24L H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
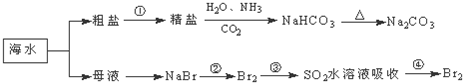
| A���ھ����Ʊ�����ʱ��һ��Ҫ��ͨ���������ͣ���ͨ������̼������ |
| B���ڵڢڲ����У���Ԫ�ر����� |
| C��������������Һ�ɼ���NaHCO3��Na2CO3 |
| D����ȡNaHCO3�ķ�Ӧ���������ܽ��С��NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����H=-488.3kJ/mol |
| B����H3=-244.15kJ/mol |
| C����H3=-977.6kJ/mol |
| D����H3=+488.3kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��71n | ||
B����
| ||
| C��35.5n | ||
D����
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com