
【题目】如图是钛元素在元素周期表中的信息示意图.从图中获取的信息正确的是( )
![]()
A.钛元素属于非金属元素B.钛原子的中子数为25.87
C.钛原子的核外电子数为47D.钛原子的质子数为22
【答案】D
【解析】
根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析判断即可。
A.根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是钛,属于金属元素,A错误;
B.根据元素周期表中的一格可知,左上角的数字为22,表示原子序数为22;根据原子序数=核电荷数=质子数=核外电子数,47.87表示的是元素的相对原子质量,由于Ti元素存在多种同位素原子,每种同位素原子含有的中子数也都是整数,不可能是小数,B错误;
C.根据元素周期表中的一格可知,左上角的数字为22,表示原子序数为22;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为22,C错误;
D.根据元素周期表中的一格可知,左上角的数字为22,表示原子序数为22;根据原子序数=核电荷数=质子数,则钛原子的质子数为22,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C均含有10个电子。它们之间转化关系如图所示。下列说法正确的是
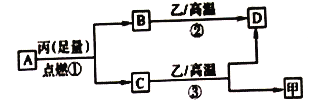
A. 原子半径:Z>Y>X B. 稳定性:A>C
C. 反应②和③均为吸热反应 D. X、Y、Z可以形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是
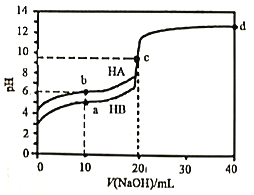
A. 水的电离度:c点溶液>纯水>b点溶液
B. 电离常数:Ka(HA)<Ka(HB)
C. d点溶液:2c(Na+)=c(A-)+(HA)
D. a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:

(1)D中的含氧官能团名称为________________(写两种)。
(2)F→G的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式____________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化

请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是制硝酸的主要反应之一,其微观示意图如下。下列说法正确的是( )

A.甲的化学式为NH3 , 其水溶液呈碱性B.该反应中元素的化合价都发生改变
C.该反应中甲、乙的质量比为17 :32D.生成物丙、丁的分子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应现象的描述错误的是( )
A. 浓硫酸加入到蔗糖中,蔗糖变黑并体积膨胀。
B. 将铜丝伸入浓硝酸中,产生红棕色气体
C. 将二氧化硫通入品红溶液中,溶液褪色
D. 氢气在氯气中燃烧,产生淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式_______________________________________。
(2)该反应的△H__________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______(填<、>或=,下同)υ逆。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中________点,比较图中B、D两点所对应的正反应速率υB_________υD,理由是___________。D点温度高于B点,温度越高反应速率越大,所以反应速率也大于B

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂
c.压缩容器的体积 d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3、Fe2O3和SiO2,工业上经过如图所示工艺可以冶炼金属铝。下列说法中不正确的是
![]()
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ④进行的操作是过滤、加热,而且d一定是氧化铝
D. ③中需要通入过量的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com