
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HA和HB溶液,溶液pH随加入NaOH溶液的体积变化曲线如图所示,下列判断错误的是
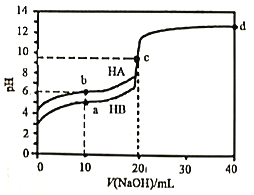
A. 水的电离度:c点溶液>纯水>b点溶液
B. 电离常数:Ka(HA)<Ka(HB)
C. d点溶液:2c(Na+)=c(A-)+(HA)
D. a点溶液:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
【答案】C
【解析】
0.1mol·L-1的HA和HB溶液pH均大于1,故两者均为弱酸,且HA的酸性更弱,据此分析解答。
A. c点为完全中和生成的盐溶液,根据起始pH可知,两种酸均为弱酸,且HA的酸性更弱,故c点为强碱弱酸盐溶液,水解促进水的电离,b点不完全中和,酸过量,酸的电离抑制水的电离,水的电离程度减小,故水的电离度:c点溶液>纯水>b点溶液,选项A正确;
B. 由图中曲线可知,HA的酸性更弱,则电离常数:Ka(HA)<Ka(HB),选项B正确;
C. d点溶液为氢氧化钠与NaA溶液按1:1形成的溶液,根据物料守恒有:c(Na+)=2c(A-)+2 c (HA),选项C错误;
D. a点溶液以HB与NaB按1:1为溶质形成的溶液,溶液呈酸性,说明电离大于水解,则:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),选项D正确。
答案选C。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的叙述正确的是( )
A.油脂是高分子化合物
B.糖类又叫碳水化合物,其分子式都可用Cn(H2O)m表示
C.蛋白质分子只含有一条肽链
D.油脂没有固定的熔、沸点,所以油脂是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米微晶碱式碳酸锌是一种新型的碱式碳酸锌,在医药行业可用作皮肤保护剂,在化妆品生产中用作基础原料。用工业级硫酸锌(主要成分ZnSO4·7H2O,含少量Fe2+、Cu2+、Cd2+、Co2+、Ni2+)制备纳米微晶碱式碳酸锌[ Zn4CO3(OH)6]的一种流程如下:
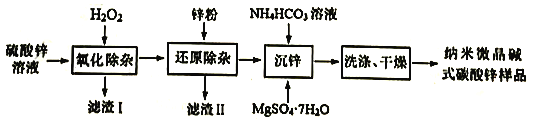
回答下列问题:
(1)配制硫酸锌溶液:①烧杯中加入100g工业级硫酸锌;②加入116mL的蒸馏水,用玻璃棒搅拌,直至完全溶解,得160mL溶液。配制时还需用到的玻璃仪器是___________,所得ZnSO4溶液的物质的量浓度约为___________。(已知ZnSO·7H2O的摩尔质量为287g·mol-1)
(2)“氧化除杂”是除去溶液中Fe2+
①滤渣I的主要成分是___________(填化学式)。
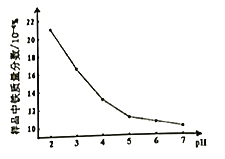
②控制其它条件不变,溶液的pH对H2O2除铁效果的影响如图,除铁时应控制溶液pH为___________(填整数值)。(已知:ksp[Zn(OH)2]=1.2×10-17,溶液体积变化忽略不计)
(3)“还原除杂”。除Cu2+、Cd2+后,再加入Zn粉和少量Sb2S3,形成锑锌微电池,提高除Co2+、Ni2+的反应速率。则Zn2+、Co2+、Sb3+的氧化性强弱顺序:___________>___________>___________(填离子符号)。_______________
(4)“沉锌时,①生成纳米微晶碱式碳酸锌的离子方程式为______________________。
②加入MgSO4·7H2O的目的主要是降低所得粉体的晶粒度,但也要保证主元素的质量分数在56%以上。下表是不同Mg:Zn(质量比)对产品品粒度及Zn质量分数的影响:
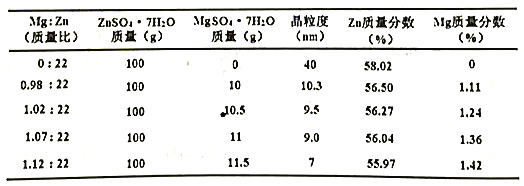
Mg︰Zn(质量比)不宜超过______________________。
(5)用EDTA滴定法测样品中锌的含量,反应式为Zn2++H2Y2-=ZnY2-+2H+。取a g纳米微晶碱式碳酸锌样品,在pH为5~6的乙酸-乙酸钠缓冲溶液中,以二甲酚橙作指示剂,用 b mol· L-1EDTA(H2Y2-)标准溶液滴定,消耗EDTA溶液c mL则样品中锌的质量分数是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是钛元素在元素周期表中的信息示意图.从图中获取的信息正确的是( )
![]()
A.钛元素属于非金属元素B.钛原子的中子数为25.87
C.钛原子的核外电子数为47D.钛原子的质子数为22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g)![]() -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1__E2(填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g)
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、k2逆分别增大a倍和b倍,则a____b(填“>”、“<”或“=”);一定条件下,2NO(g)+O2(g) ![]() 2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2(g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。

②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):

2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com