
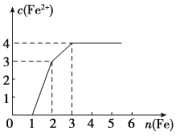
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1∶1∶1B.1∶3∶1
C.3∶3∶8D.1∶1∶4
【答案】D
【解析】
分析溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系图,可知,加入1mol铁粉,此时c(Fe2+)为0,说明此时发生反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O。再加入1mol铁粉,c(Fe2+)由0变为3,可知此时发生反应:2Fe(NO3)3+Fe=3Fe(NO3)2。当加入铁粉的物质的量为3mol时,c(Fe2+)浓度由3变为4,则发生了:Cu(NO3)2+Fe=Fe(NO3)2+Cu。据此分析。
将铁粉加入该稀溶液中,依次发生的反应是Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,2Fe(NO3)3+Fe=3Fe(NO3)2,Cu(NO3)2+Fe=Fe(NO3)2+Cu。由图可知,稀硝酸消耗1 molFe同时生成1molFe(NO3)3,溶液中Fe(NO3)3消耗了1mol Fe,而Cu(NO3)2消耗了1mol Fe,结合反应方程式可知,消耗1 mol Fe需要4 molHNO3、2molFe(NO3)3和1 molCu(NO3)2,则原溶液中有4 mol HNO3、1molFe(NO3)3,1 molCu(NO3)2,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1∶1∶4。D项正确;
答案选D。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。

已知:①![]()
②![]()
③![]()
请回答下列问题:
(1)下列有关F的说法正确的是_________。
A.分子式是![]() B.F即能与HCl又能与
B.F即能与HCl又能与![]() 反应生成盐
反应生成盐
C.能发生取代反应和缩聚反应 D.![]() 的F最多可以和
的F最多可以和![]() 反应
反应
(2)C→D的反应类型是________。
(3)在合成F的过程中,B→C步骤不能省略,理由是______________。
(4)D→E反应所需试剂是____________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)____。
①苯环上只有两种不同化学环境的氢原子②分子中含有![]()
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。_______________注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
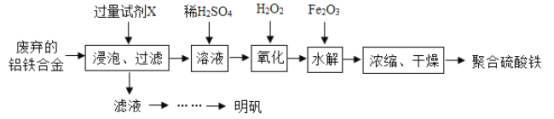
(1)室温下Ksp[Fe(OH)3]=4×l0-38制备Fe(OH)3的过程中,pH=7时溶液中c(Fe3+) =________。
(2)聚合硫酸铁是一种无瑪无窖、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①写出流程中的“氧化”时发生的离子方程式_______,浓缩时向其中加入一定量的乙醇,加入乙醇的目的是_________。
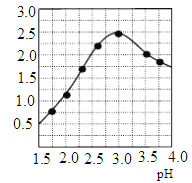
②加入试剂Y的目的是调节pH,所加试剂Y为_______;溶液pH对[Fe2(OH) x (SO4)y]n中x的值有较大影响(如图所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因:____________。
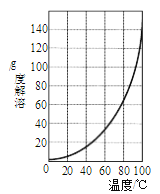
(3)明矾是一种常见铝钾硫酸盐。
①为充分利用原料,试剂X应为_______。
②请结合图所示的明矾溶解度曲线,补充完整由滤液I制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液I中加入足量的含铝废铁屑至不再有气泡产生,过滤,_____。将溶液_______、过滤、并用酒精洗涤、干燥,最终得到明矾晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
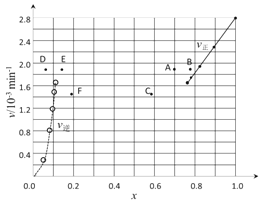
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是
A. 该物质能使溴水和酸性髙锰酸钾溶液褪色,褪色原理完全相同
B. 苯乙烯分子的所有原子不可能在同一平面上
C. 该物质苯环上的一溴取代物有3种
D. 除去乙苯中混有的苯乙烯,可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
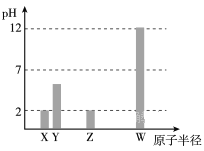
A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.l00mol·L-1的NaOH溶液滴定10.00mL浓度均0.l00mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中洛液的电导率如下图所示。下列说法不正确的是( )
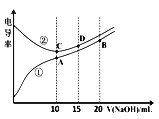
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com