

2- 3 |
| ||
| ||
| 1.16×106g |
| 116g/mol |
| 10 |
| 3 |
| 105 |
| 3 |
| 3.33×104mol |
| 1mol/L |


科目:高中化学 来源: 题型:
| A、氧元素的质量比为1:1 |
| B、SO2和SO3的质量比为1:1 |
| C、原子总数之比为1:1 |
| D、分子数之比为1:1 |
查看答案和解析>>
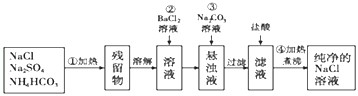
科目:高中化学 来源: 题型:
查看答案和解析>>
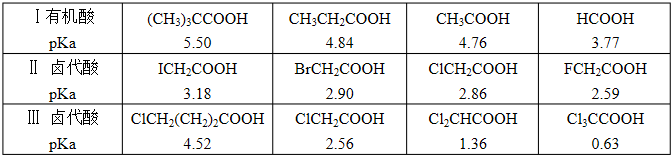
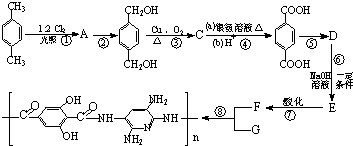
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
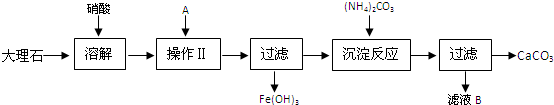
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取乙烯时,应把无水乙醇与3mol/L的H2SO4混合均匀后迅速升温至170℃ |
| B、分馏操作中,温度计水银球应放置在蒸馏烧瓶支管口附近 |
| C、除去乙酸乙酯中乙酸杂质的方法是加入饱和NaOH溶液,充分振荡、静置后,分液 |
| D、检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com