
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。
【答案】![]() (或
(或![]() ) 第三周期ⅢA族 < 3 p 哑铃
) 第三周期ⅢA族 < 3 p 哑铃 ![]()
![]()
![]()
![]() (或
(或![]() )和
)和![]()
【解析】
短周期元素中,A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl,E是L层上有2对成对电子,则E为O,据此分析作答。
(1)A为Na,其核外电子排布式为![]() (或
(或![]() );
);
(2)B为铝元素,铝元素在周期表中的位置第三周期ⅢA族,Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)<r(Na+);
(3)C为N元素,原子的轨道表示式为![]() ,原子核外有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈哑铃形,故答案为:3;p;哑铃;
,原子核外有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈哑铃形,故答案为:3;p;哑铃;
(4)D为Cl,电子排布式为1s22s22p63s23p5;氯离子为氯原子得到1个电子形成的,离子结构示意图为 ;
;
(5)氮元素的2p轨道电子处于半充满稳定状态,第一电离能大于氧元素,即![]() 、
、![]() 元素的第一电离能的大小关系是N>O;
元素的第一电离能的大小关系是N>O;
(6)NCl3分子中N显-3价,Cl显+1价,因此电负性大小关系是N>Cl;根据原子守恒可知NCl3与水反应的产物为NH3(或NH3·H2O)和HClO。


科目:高中化学 来源: 题型:
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是_________(用离子方程式表示)
(2)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_________________。
(3)室温下将0.12 mol/L HCl溶液与0.1 mol/L NaOH溶液等体积混合,混合液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某有机物
某有机物![]() 与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重
与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重![]() 、
、![]() ;同温同压下,
;同温同压下,![]() 蒸气的密度是
蒸气的密度是![]() 的37倍。则能够与钠反应放出
的37倍。则能够与钠反应放出![]() 的
的![]() 的结构有(不考虑立体异构)( )
的结构有(不考虑立体异构)( )
A.6种B.5种C.4种D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
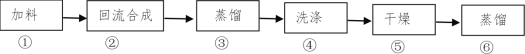
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了元素周期表中前20号元素中某些元素性质的一些数据:
性质元素 | 原子半径( | 最高价态 | 最低价态 |
① | 1.02 |
|
|
② | 2.27 |
| — |
③ | 0.74 | — |
|
④ | 1.43 |
| — |
⑤ | 0.77 |
|
|
⑥ | 1.10 |
|
|
⑦ | 0.99 |
|
|
⑧ | 1.86 |
| — |
⑨ | 0.75 |
|
|
⑩ | 1.17 |
|
|
试回答下列问题。
(1)以上10种元素中,第一电离能最小的是______(填序号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质有______(填分子式,两种即可)。元素⑨和⑩形成的化合物的化学式为______;元素①的原子价电子排布式是______。
(3)①、⑥、⑦、⑩四种元素的简单氢化物的稳定性由强到弱的顺序是______(填化学式)。
(4)③和⑨两元素相比,非金属性较弱的是______(填名称),可以验证该结论的是______(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.最简单氢化物的稳定性
F.两单质在自然界中的存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+1/2O2(g)![]() SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
A. 3/2B. 2/3C. 6/5D. 5/6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中正确的是
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③除去溴苯中的少量溴:加入NaOH溶液,振荡、静置分层后,除去水层
④除去乙酸乙酯中残留的乙酸,加过量饱和![]() 溶液振荡后,静置分液
溶液振荡后,静置分液
⑤塑料、橡胶和光导纤维都是合成高分子材料
⑥石油的分馏、裂化和煤的干馏都是化学变化
A.①⑤⑥B.①②③⑤C.②③④D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
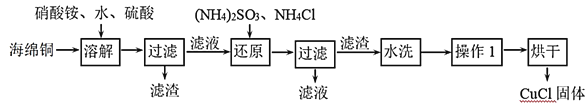
(1)还原过程中主要反应的离子方程式为_______。
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
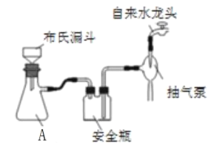
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com