
【题目】![]() 某有机物
某有机物![]() 与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重
与足量的氧气充分反应后,将所得气体产物依次通过盛有浓硫酸和碱石灰的装置,两装置分别增重![]() 、
、![]() ;同温同压下,
;同温同压下,![]() 蒸气的密度是
蒸气的密度是![]() 的37倍。则能够与钠反应放出
的37倍。则能够与钠反应放出![]() 的
的![]() 的结构有(不考虑立体异构)( )
的结构有(不考虑立体异构)( )
A.6种B.5种C.4种D.3种
【答案】C
【解析】
有机物燃烧生成二氧化碳和水,依次被浓硫酸吸收水、碱石灰吸收二氧化碳。根据阿伏加德罗定律,同温同压下的气体,气体体积和物质的量成正比,据此回答问题。
产物通过浓硫酸增重9g,吸收9g水,n(H原子)=![]() ;通过碱石灰增重17.6g,吸收17.6g二氧化碳,n(C原子)=
;通过碱石灰增重17.6g,吸收17.6g二氧化碳,n(C原子)=![]() ,即n(H原子):n(C原子)=1:0.4=5:2。
,即n(H原子):n(C原子)=1:0.4=5:2。
根据PV=nRT(R为常数)可知,![]() ,即同温同压下,气体密度与气体摩尔质量成正比,
,即同温同压下,气体密度与气体摩尔质量成正比,![]() 蒸气的密度是
蒸气的密度是![]() 的37倍,即A的摩尔质量为74g/mol。综上所述,n(有机物):n(H原子):n(C原子)=0.1:1:0.4=1:10:4;根据摩尔质量可知,分子中含有1个氧原子,有机物分子式为C4H10O,即若能够与钠反应放出
的37倍,即A的摩尔质量为74g/mol。综上所述,n(有机物):n(H原子):n(C原子)=0.1:1:0.4=1:10:4;根据摩尔质量可知,分子中含有1个氧原子,有机物分子式为C4H10O,即若能够与钠反应放出![]() 的结构含有羟基,属于饱和一元醇,丁烷有正丁烷和异丁烷两种结构,因此,正丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,异丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,共有4种。
的结构含有羟基,属于饱和一元醇,丁烷有正丁烷和异丁烷两种结构,因此,正丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,异丁烷中有2种不同环境的氢,其被1个羟基取代的产物有2种,共有4种。
答案为C。


科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在150℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是( )
A.CH4 和C2H4B.CH4 和C3H6C.C2H2 和C3H4D.C2H2 和C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是
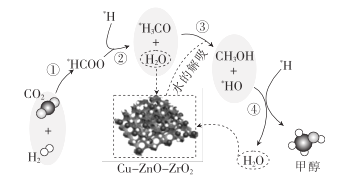
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
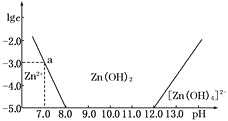
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是__________________。
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表:
c(HCl) | |||||||
(mol/L) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103c(PbCl2) | |||||||
(mol/L) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 14.01 |
根据上表数据判断下列说法正确的是________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大 |
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度 |
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子) |
D.PbCl2固体可溶于饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NH3H2O与醋酸的电离度在同温同浓度下相等。向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4++H2O![]() NH3H2O+H+ (2)
NH3H2O+H+ (2)
H++OH-![]() H2O (3)
H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4Cl=NH4++Cl- (2)
NH4++OH-![]() NH3H2O (3)
NH3H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。
(1)他选用的试剂是__________(填写编号)。
A. NH4NO3 B. CH3COONH4 C. Na2CO3 D. NH3H2O
(2)实验步骤:____________________________;
(3)实验结论:____________________________。
Ⅱ.关于“电解氯化铜溶液时的pH变化”问题,化学界有两种不同的观点。
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高;
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时的pH的变化如图。请回答下列问题:
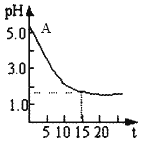
(1)用离子方程式表示电解前氯化铜溶液的pH处于A点的原因:______________。
(2)“理论派”所持观点的理论依据是:_______________________。
(3)你支持哪种观点:_________(理论派、实验派)。其理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 只含有
只含有![]() 、
、![]() 、
、![]() 三种元素,常用作有机合成的中间体。
三种元素,常用作有机合成的中间体。![]() 该有机物在足量
该有机物在足量![]() 中充分燃烧生成
中充分燃烧生成![]()
![]() 和
和![]()
![]() ,质谱图表明其相对分子质量为84,分析其红外光谱图可知
,质谱图表明其相对分子质量为84,分析其红外光谱图可知![]() 分子中含有
分子中含有![]() 键和位于端点处的
键和位于端点处的![]() 键,核磁共振氢谱上有三组峰,峰面积之比为
键,核磁共振氢谱上有三组峰,峰面积之比为![]() 。
。
(1)![]() 的分子式是______。
的分子式是______。
(2)![]() 的结构简式是______。
的结构简式是______。
(3)下列物质中,一定条件下能与![]() 发生反应的是______(填序号)。
发生反应的是______(填序号)。
A.![]() B.
B.![]()
C.酸性![]() 溶液 D.
溶液 D.![]() 的
的![]() 溶液
溶液
(4)有机物![]() 是
是![]() 的同分异构体,
的同分异构体,![]()
![]() 最多可与
最多可与![]()
![]() 完全加成。已知
完全加成。已知![]() 中所有碳原子在同一个平面上,且没有顺反异构现象,则
中所有碳原子在同一个平面上,且没有顺反异构现象,则![]() 的结构简式为______。
的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然水因含有Ca2+、Mg2+、HCO3—等离子,煮沸后会形成水垢。现有一种干燥水垢6.32g ,加热除去全部结晶水,得到固体M 5.78 g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g。下列推断合理的是( )
A.M 中一定不含Mg(OH)2B.M中一定含有MgCO3
C.5.78 g M中含CaCO30.05molD.水垢中碳酸盐质量分数为0.823
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z代表三种元素。已知:①![]() 和
和![]() 两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的
两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9;③Y和Z两种元素可以形成4核42电子的![]() 价阴离子。
价阴离子。
(1)Y元素是______(填元素符号,下同),其原子的核外电子排布式为______,Z元素是______,其原子结构示意图为______
(2)由X、Y、Z三种元素形成的含68个电子的盐类化合物的化学式是______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com