
| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强酸 | |
| D. | 硒化氢是无色气体,没有H2S稳定 |
分析 A.Be与Al位于周期表中的对角线位置,氧化物对应水化物的性质相似;
B.卤素单质从上到下颜色加深、状态由气-液-固变化,非金属性减弱,AgX不溶于硝酸;
C.硫酸钡不溶于水和硝酸,氢氧化钡为强碱,同主族元素的化合物性质相似;
D.同主族从上到下非金属性减弱,非金属性越强,氢化物越稳定.
解答 解:A.Be与Al位于周期表中的对角线位置,氧化物对应水化物的性质相似,则铍是一种轻金属,它的氧化物对应水化物可能是两性,故A正确;
B.卤素单质从上到下颜色加深、状态由气-液-固变化,非金属性减弱,AgX不溶于硝酸,则砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀,故B正确;
C.硫酸钡不溶于水和硝酸,氢氧化钡为强碱,同主族元素的化合物性质相似,则硫酸锶难溶于水和稀HNO3,其氢氧化物为强碱,故C错误;
D.同主族从上到下非金属性减弱,非金属性S>Se,则硒化氢是无色气体,没有H2S稳定,故D正确;
故选C.
点评 本题考查周期表与周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答该题的关键,侧重于学生的分析能力和应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 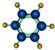 |
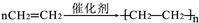 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
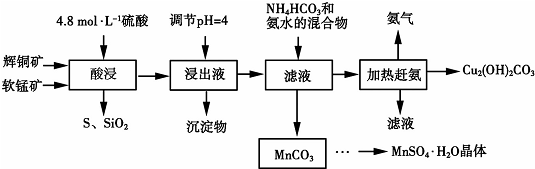
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | Z | |
| X | Y |
| A. | 原子半径:Z<W<Y<X | |
| B. | Z的最高价氧化物的水化物可与其氢化物反应 | |
| C. | 最简单气态氢化物的热稳定性:Y<W | |
| D. | W、Z的氧化物都能与碱反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
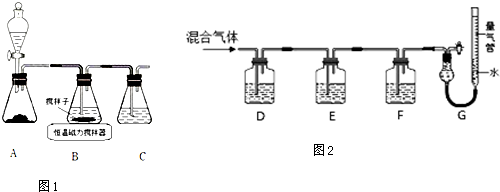

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质:硫磺、石英、水银 | B. | 化合物:盐酸、食盐、烧碱 | ||
| C. | 混合物:空气、胶体、海水 | D. | 非电解质:铜、蔗糖、酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com