
【题目】硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 , 该能层具有的原子轨道数为、电子数为 .
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4 , 该反应的化学方程式为 .
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C﹣C | C﹣H | C﹣O | Si﹣Si | Si﹣H | Si﹣O |
键能/(kJmol﹣1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 .
②SiH4的稳定性小于CH4 , 更易生成氧化物,原因是 .
(6)在硅酸盐中,SiO4﹣4四面体(如图1)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(2)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 , Si与O的原子数之比为 , 化学式为 . 
【答案】
(1)M;9;4
(2)二氧化硅
(3)共价键;3
(4)Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2
(5)C﹣C键和C﹣H键较强,所形成的烷烃稳定,而硅烷中Si﹣Si键和Si﹣H键的键能较低,易断裂,导致长链硅烷难以生成;C﹣H键的键能大于C﹣O键,C﹣H键比C﹣O键稳定,而Si﹣H键的键能却远小于Si﹣O键,所以Si﹣H键不稳定而倾向于形成稳定性更强的Si﹣O键
(6)sp3;1:3;[SiO3]n2n﹣(或SiO32﹣)
【解析】解:(1.)原子中,离原子核越远的电子层其能量越高,所以Si原子中M电子层能量最高;该原子中含有3个s轨道、6个p轨道,所以一共有9个轨道,电子数为4,故答案为:M;9;4;
(2.)硅属于亲氧元素,在自然界中不能以单质存在,主要以二氧化硅和硅酸盐存在,故答案为:二氧化硅;
(3.)硅单质中硅硅之间以共价键结合,硅晶胞中每个顶点上有1个Si、面心是有1个Si、在晶胞内部含有4个Si原子,利用均摊法知,面心提供的硅原子个数=6× ![]() =3,故答案为:共价键;3;
=3,故答案为:共价键;3;
(4.)可使湿润的红色石蕊试纸变蓝的气体是氨气,再根据元素守恒知还生成氯化镁MgCl2 , 所以反应方程式为:Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2 , 故答案为:Mg2Si+4NH4Cl=SiH4↑+4NH3↑+2MgCl2;
(5.)①键能越大形成的化学键越稳定,C﹣C键和C﹣H键的键能大于Si﹣Si键和Si﹣H键的键能,所以C﹣C键和C﹣H键较强,所形成的烷烃稳定,而硅烷中Si﹣Si键和Si﹣H键的键能较低,易断裂,导致长链硅烷难以生成,故答案为:C﹣C键和C﹣H键较强,所形成的烷烃稳定,而硅烷中Si﹣Si键和Si﹣H键的键能较低,易断裂,导致长链硅烷难以生成;②键能越大形成的化学键越稳定,CC﹣H键的键能大于Si﹣H键的键能,而Si﹣H键的键能却远小于Si﹣O键,所以Si﹣H键不稳定而倾向于形成稳定性更强的Si﹣O键,故答案为:C﹣H键的键能大于C﹣O键,C﹣H键比C﹣O键稳定,而Si﹣H键的键能却远小于Si﹣O键,所以Si﹣H键不稳定而倾向于形成稳定性更强的Si﹣O键;
(6.)Si原子形成四个σ键,Si原子的杂化形式为sp3 , 根据图片知,每个三角锥结构中Si原子是1个,O原子个数=2+2× ![]() =3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n﹣ (或SiO32﹣),故答案为:sp3;1:3;[SiO3]n2n﹣ (或SiO32﹣).
=3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n﹣ (或SiO32﹣),故答案为:sp3;1:3;[SiO3]n2n﹣ (或SiO32﹣).
(1)原子中,离原子核越远的电子层其能量越高;该原子中含有3个s轨道、6个p轨道;(2)硅属于亲氧元素,在自然界中主要以二氧化硅和硅酸盐存在;(3)非金属元素之间易形成共价键;利用均摊法计算;(4)可使湿润的红色石蕊试纸变蓝的气体是氨气,再根据元素守恒知还生成氯化镁MgCl2;(5)①键能越大形成的键越稳定;②键能越大形成的化学键越稳定,键能越小越不稳定;(6)利用均摊法计算其原子个数比,从而确定其化学式.


科目:高中化学 来源: 题型:
【题目】诺贝尔化学奖得主GerhardErtl曾深入研究了Pt金属表面催化CO氧化反应的模型,下列关于![]() 的说法正确的是( )
的说法正确的是( )
A. ![]() 的中子数与质子数之差是134 B.
的中子数与质子数之差是134 B. ![]() 的核外电子数是202
的核外电子数是202
C. ![]() 和
和![]() 互称为同位素 D.
互称为同位素 D. ![]() 和
和![]() 是同一种核素
是同一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是
A. 往容积一定的容器中再通入O2,可以加快反应2SO2+O2![]() 2SO3的反应速率
2SO3的反应速率
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 对于C(s)+H2O(g)![]() CO(g)+H2(g)的反应,加入固体炭,反应速率加快
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定气体体积的因素:①气体分子的直径、②气体的物质的量多少、③气体分子间的平均距离、④气体分子的相对分子质量,则决定气体体积的因素主要为( )
A. ①②B. ①③C. ②③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硝酸银溶液为滴定液,测定能与Ag+反应生成难溶性电解质的一种容量分析方法叫银量法。其原理如下:
①Ag++X-=AgX↓(X-表示Cl-、Br-、I-、CN-、SCN-等离子)——用于定量计算
②2Ag++CrO42-=Ag2CrO4↓(砖红色)——用于指示滴定的終点
[已知: Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=1.12×10-12]。
某氯碱厂为测定饱和食盐水被电解后所得淡盐水(见图)里氯化钠的浓度,采用以上银量法,每次取20.00ml 淡盐水进行滴定,共进行了三次。据此,回答下列问题:

(1)配制100mL 0.4mol/L的硝酸银溶液(标准液)时,需要用托盘天平称取____gAgNO3固体,制成的溶液需置于棕色试剂瓶中(备用),原因是_______________。
(2)为了使溶液中的Cl-恰好沉淀完全(溶液中残余Cl-的浓度是1.0×10-5mol/L),溶液中(CrO42-)的浓度度应为______mol/L,若CrO42-的浓度大于此数值,则测定结果会偏_____(填“高”或“低”)。滴定时,若此时消耗AgNO3溶液25.00mL.( 三次实验的平均值),则淡盐水中氯化钠的浓度是______mol/L。
(3)根据相关离子的性质,滴定时溶液的pH值应控制在6.5~10,pH值太大或太小对实验均有不良影响,pH值太大的不良影响是__________(用离子反应方程式表示)。
(4)AgCl沉淀易吸附Cl-为减少AgC1沉淀对Cl-的吸附,从而减小实验的误差,实验时应采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法不正确的是

A. 原子半径:Y>Z>W B. 一定条件下,Y可置换出X
C. 气态氢化物稳定性:Z>W D. 熔点YW2>XW4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
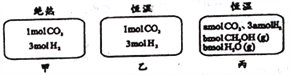
A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙
C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关键能数据如表:
化学键 | Si﹣O | O=O | Si﹣Si |
键能/kJmol﹣1 | X | 498.8 | 176 |
晶体硅的燃烧热为989.2kJmol﹣1 , 则X的值为( )
A.423.3
B.460
C.832
D.920
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:2H++2e-=H2↑,发生氧化反应
A. ①②③ B. ②④ C. ②③④ D. ③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com