
分析 这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,计算2.8g有机物的物质的量,结合生成水和二氧化碳的质量可计算有机物的分子式,并以此确定有机物同分异构体的结构简式.
解答 解:(1)这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56;
n(A)=$\frac{2.8g}{2×28g/mol}$=0.05mol,
n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,
n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,
故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,
因为12×4+1×8=56=M(A),所以没有O元素;
∴分子式为C4H8,
答:该有机物的分子式为C4H8;
(2)已知分子式为C4H8,且为链状结构,则分子中有一个C=C,则结构简式为:CH2=CHCH2CH3,CH3CH=CH2CH3 , ,
,
答:该有机物链状同分异构体的结构简式有CH2=CHCH2CH3,CH3CH=CH2CH3 , .
.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据有机物生成的二氧化碳和水的质量结合相对分子质量可判断有机物的分子式,注意有机物的结构特点.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 既可以通过复分解反应又可以通过化合反应生成Fe(OH)3 | |
| B. | SO2、SiO2、CO均为酸性氧化物 | |
| C. | 强电解质的导电性一定大于弱电解质的导电性 | |
| D. | 同种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一类甲烷燃烧电池示意图.
如图是一类甲烷燃烧电池示意图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
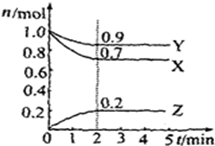 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,SO2的浓度与SO3的浓度相等 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 为了提高SO2的转化率,应适当提高O2的浓度 | |
| D. | 在上述条件下,SO2不可能100%转化为SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com