
【题目】聚合物H是一种聚酰胺纤维,其结构简式为![]() 。该聚合物可广泛用于各种刹车片,其合成路线如下图所示:
。该聚合物可广泛用于各种刹车片,其合成路线如下图所示:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是________,D的名称是________,F中所含官能团的名称是_________。
(2)B的结构简式是________;“B→C”的反应中,除C外,还生成的一种无机产物是______(填化学式)。
(3)D+G→H的化学方程式是_________。
(4)Q是D的同系物,其相对分子质量比D大14,则Q可能的结构有______种。其中,核磁共振氢谱有4组峰,且峰面积比为1∶2∶2∶3的结构简式为_______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成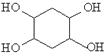 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
【答案】消去反应 对苯二甲酸(或1,4-苯二甲酸) 硝基、氯原子 ![]() H2O
H2O 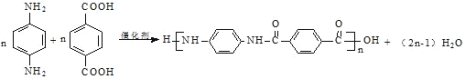 10
10  (任写一种)
(任写一种) 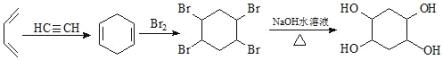
【解析】
乙醇发生消去反应生成A为CH2=CH2,C被氧化生成D,D中含有羧基,C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子,C发生氧化反应生成D,D中应该有两个羧基,根据H结构简式知,D为![]() 、G为
、G为![]() ;根据信息②知,生成B的反应为加成反应,B为
;根据信息②知,生成B的反应为加成反应,B为![]() ,B生成C的反应中除了生成C外还生成H2O,苯和氯气发生取代反应生成E,E为
,B生成C的反应中除了生成C外还生成H2O,苯和氯气发生取代反应生成E,E为![]() ,
,![]() 发生取代反应生成F,根据G结构简式知,发生对位取代,则F为
发生取代反应生成F,根据G结构简式知,发生对位取代,则F为![]() ,F发生取代反应生成对硝基苯胺。
,F发生取代反应生成对硝基苯胺。
⑴C2H5OH与浓H2SO4在170℃下共热发生消去反应生成的A为H2C=CH2;由H的结构简式可知D为![]() 、G为
、G为![]() ;D为对苯二甲酸,苯与Cl2在FeCl3作催化剂的条件下反应生成的E(
;D为对苯二甲酸,苯与Cl2在FeCl3作催化剂的条件下反应生成的E(![]() ),E发生硝化反应生成的F(
),E发生硝化反应生成的F(![]() ),F中所含官能团的名称是硝基和氯原子;故答案为:消去反应;对苯二甲酸(或1,4-苯二甲酸);硝基、氯原子。
),F中所含官能团的名称是硝基和氯原子;故答案为:消去反应;对苯二甲酸(或1,4-苯二甲酸);硝基、氯原子。
⑵乙烯和![]() 发生Diels-Alder反应生成B,故B的结构简式是
发生Diels-Alder反应生成B,故B的结构简式是![]() ;C为芳香族化合物,分子中只含两种不同化学环境的氢原子,“B→C”的反应中,除C外,还生成的一种无机产物是H2O;故答案为:
;C为芳香族化合物,分子中只含两种不同化学环境的氢原子,“B→C”的反应中,除C外,还生成的一种无机产物是H2O;故答案为:![]() ;H2O。
;H2O。
⑶D+G→H的化学方程式是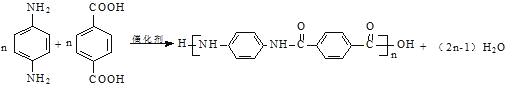 ;故答案为:
;故答案为: 。
。
⑷D为![]() ,Q是D的同系物,相对分子质量比D大14,如果取代基为CH2COOH、COOH,有3种结构;如果取代基为CH3、两个COOH,有6种结构;如果取代基为CH(COOH)2,有1种,则符合条件的有10种;其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为
,Q是D的同系物,相对分子质量比D大14,如果取代基为CH2COOH、COOH,有3种结构;如果取代基为CH3、两个COOH,有6种结构;如果取代基为CH(COOH)2,有1种,则符合条件的有10种;其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为 ,故答案为:10;
,故答案为:10; 。
。
⑸CH2=CHCH=CH2和HC≡CH发生加成反应生成![]() ,
,![]() 和溴发生加成反应生成
和溴发生加成反应生成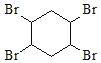 ,
, 发生水解反应生成
发生水解反应生成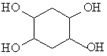 ,其合成路线为
,其合成路线为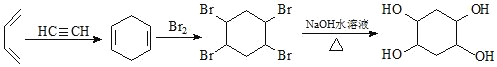 ,故答案为:
,故答案为: 。
。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
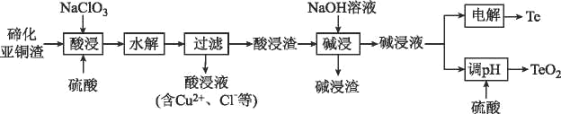
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子排布图正确的是( )
A.O原子的电子排布图![]()
B.基态镁原子的电子排布图为![]()
C.基态磷原子的最外层电子排布图为![]()
D.基态铜原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是( )
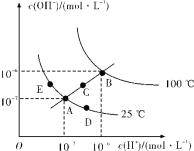
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量NaOH的方法
C.若从A点到C点,可采用温度不变时在水中加入适量H2SO4的方法
D.100℃时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.20 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+数为2NA
C.标准状况下,22.4 L水中含有的共价键数为2NA
D.50 mL 12 mol·L-1的浓盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应:2A(g)B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表:下列说法正确的是( )
物质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
A.反应前20s内的平均反应速率为v(A)=0.6molL-1s-1
B.20s时,正反应速率大于逆反应速率
C.达到平衡时,A(g)的转化率为100%
D.若升高温度平衡常数变为2,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 1 mol甲基(-CH3)所含的电子数为10NA
B. 常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA
C. 14g由乙烯和环丙烷(![]() )组成的混合气体中,含有的原子总数为3NA
)组成的混合气体中,含有的原子总数为3NA
D. 标准状况下,22.4L四氯化碳中含有共用电子对的数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com