考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
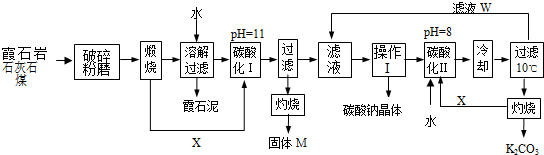
分析:霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾,以此分析解答.
(1)由于霞石岩加石灰石和煤粉碎煅烧,根据煅烧需要很高的温度来分析;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO
2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)
3Al
2O
3+3H
2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO
2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na
+、K
+、HCO
3-.
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即可.
(5)已知NaHCO
3溶液的pH约为8~9,Na
2CO
3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-.
(6)由于NaHCO
3溶液的pH约为8~9,Na
2CO
3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO
3结晶析出.
解答:
解:霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾;
(1)由于霞石岩加石灰石和煤粉碎煅烧,煅烧需要很高的温度,所以煤的作用为:与氧气反应放热,达到煅烧的温度,故答案为:与氧气反应放热,达到煅烧的温度;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO
2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)
3Al
2O
3+3H
2O,故答案为:2Al(OH)
3Al
2O
3+3H
2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO
2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na
+、K
+、HCO
3-,故答案为:CO
2;CaSiO
3;Na
+、K
+、HCO
3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO
3溶液的pH约为8~9,Na
2CO
3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-.故答案为:2AlO
2-+CO
2+3H
2O=2Al(OH)
3↓+CO
32-.
(6)由于NaHCO
3溶液的pH约为8~9,Na
2CO
3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO
3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO
3结晶析出.
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高.试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.