


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
查看答案和解析>>
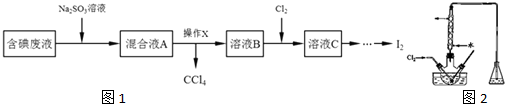
科目:高中化学 来源: 题型:

查看答案和解析>>
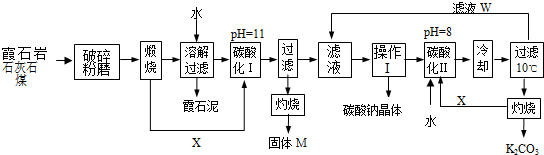
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
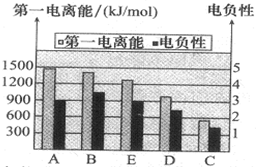 A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
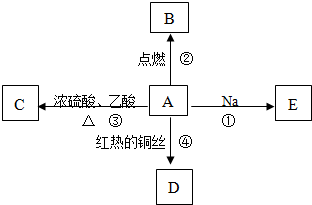
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
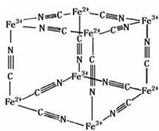 普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A、化学式可以表示为KFe2(CN)6 |
| B、一个立方体中含有12个π键 |
| C、普鲁士蓝中含有配位键 |
| D、Fe3+周围有12个Fe2+离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com