
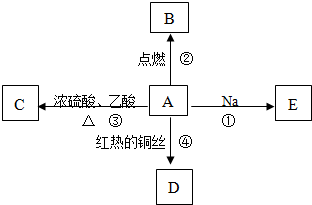
| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |


科目:高中化学 来源: 题型:
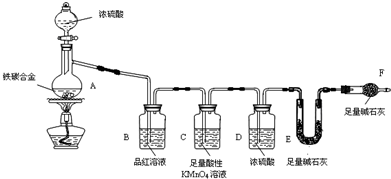
查看答案和解析>>
科目:高中化学 来源: 题型:
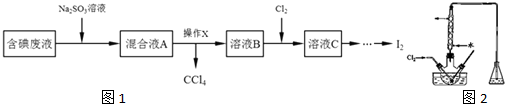
查看答案和解析>>
科目:高中化学 来源: 题型:
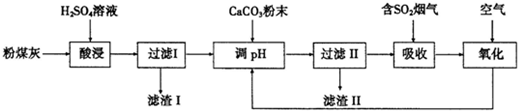
查看答案和解析>>
科目:高中化学 来源: 题型:
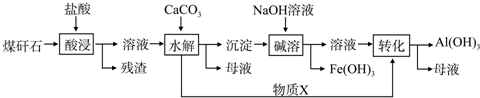
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中 |
| B、蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解 |
| C、蒸馏时需从冷凝管上口进水,下口出水 |
| D、分液时,下层液体放完后,再从下口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
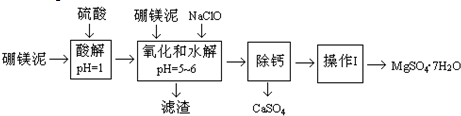
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:
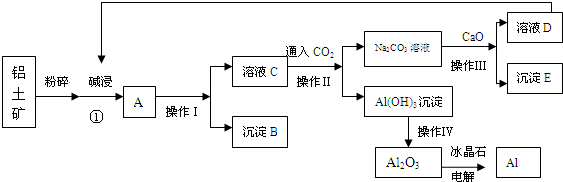
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com