
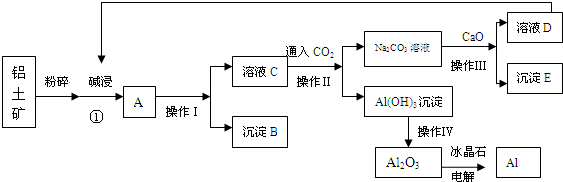


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
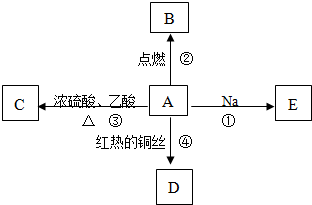
查看答案和解析>>
科目:高中化学 来源: 题型:
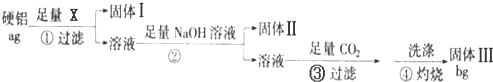
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温度 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、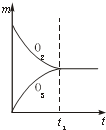 |
C、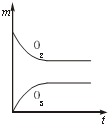 |
D、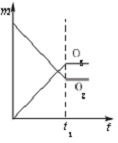 |
查看答案和解析>>
科目:高中化学 来源: 题型:
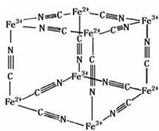 普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A、化学式可以表示为KFe2(CN)6 |
| B、一个立方体中含有12个π键 |
| C、普鲁士蓝中含有配位键 |
| D、Fe3+周围有12个Fe2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
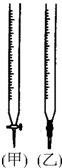 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下:| 实验序号 | 待测液体积(mL) | 所消耗NaOH标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.54 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com