

| ||
| ||


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、1 mol NaCl固体溶于1 L水所得溶液中NaCl的物质的量浓度为1 mol?L-1 |
| B、2.3 g钠转化为钠离子时失去的电子数目为0.1NA |
| C、常温常压下,11.2 L H2所含的原子数目为NA |
| D、28 g氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B、L层电子数为奇数的所有元素都是非金属元素 |
| C、ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
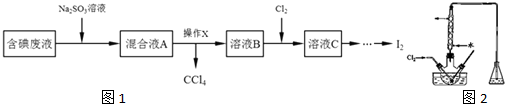
查看答案和解析>>
科目:高中化学 来源: 题型:
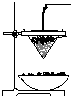 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.
铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物.某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验.查看答案和解析>>
科目:高中化学 来源: 题型:
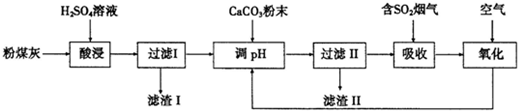
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中 |
| B、蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解 |
| C、蒸馏时需从冷凝管上口进水,下口出水 |
| D、分液时,下层液体放完后,再从下口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
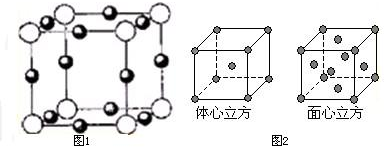
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com