
【题目】相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )
A.浓硫酸B.稀硫酸C.浓硝酸D.稀硝酸
科目:高中化学 来源: 题型:
【题目】有关晶体的叙述正确的是( )
A.在24 g石墨中,含C-C共价键键数为3 mol
B.在12 g金刚石中,含C-C共价键键数为4 mol
C.在60 g二氧化硅中,含Si-O共价键键数为4 mol
D.在NaCl晶体中,与Na+最近且距离相等的Na+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.已知草酸氢钾溶液呈酸性,则在0.1mol·L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4)
B.常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7
C.常温下,在0.10mol·L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大
D.pH=3的0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:
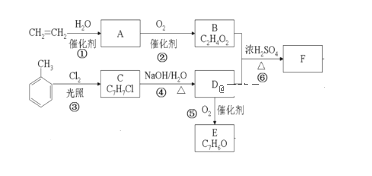
请回答:
(1)B中官能团的名称是_____,反应④的反应类型是_____。
(2)F的结构简式______________。
(3)反应①的化学方程式是___________,反应⑤的化学方程式是_________。
(4)下列有关说法不正确的是________。
A.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
B.E能与新制的Cu(OH)2悬浊液发生反应,但B不能
C.1molE和足量H2反应,最多消耗4molH2
D.D的同分异构体中能与NaOH溶液发生反应的有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,
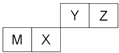
其中只有M为金属元素,下列说法不正确的是( )
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.X的最高价氧化物不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)FeCl3的水溶液呈___(填“酸性”、“碱性”或“中性”),原因是_____(用离子方程式表示);实验室配制FeCl3的水溶液时,需加入______;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(II)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3处
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如图所示,其读数为_______mL。

(2)根据下列数据:

请计算待测烧碱溶液的浓度为______mol/L。
(3)下列实验操作会使实验结果偏高的是_______。
A.锥形瓶用待测液润洗后再注入待测液
B.酸式滴定管未用标准液润洗,便装入标准液
C.酸式滴定管滴定前俯视读数,滴定后仰视读数
D.酸式滴定管滴定前有气泡,滴定后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
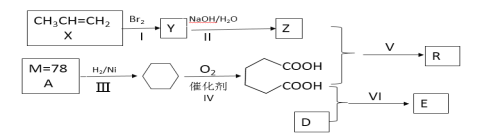
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
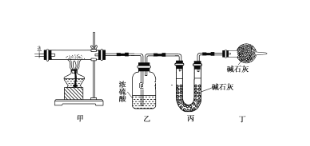
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中________________(填现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是___________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____________(填字母)连接在________(填装置连接位置)。
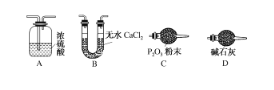
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
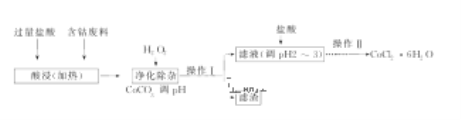
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为___________________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整pH为2~3的目的为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com