
| A、1mol Cl2含有的电子数是2NA |
| B、在标准状况下,NA个水分子所占有的体积约为22.4L |
| C、4.0g NaOH中含有阴离子的数目为0.1NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |


科目:高中化学 来源: 题型:
| A、在原电池的负极和电解池的阳极上都发生得电子的氧化反应 |
| B、金属的化学腐蚀比电化学腐蚀更普遍 |
| C、甲醇燃料电池是把热能直接转化为电能 |
| D、镀层破损后,白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氦气中有2NA个氦原子 |
| B、2L 0.3mol/L Na2SO4溶液中含0.6NA个Na+ |
| C、14g氮气中含NA个氮原子(氮的相对原子质量为14) |
| D、18g水中所含的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
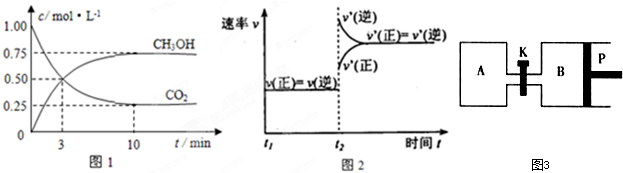
| A、达平衡时,A的物质的量浓度2.0 mol/L |
| B、达平衡时,B的转化率20% |
| C、此5s内D的平均反应速率为0.2 mol?L-1?min-1 |
| D、x≥3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、碳酸氢钙和盐酸反应HCO3-+H+═CO2↑+H2O |
| C、过量氢氧化钙与碳酸氢钠溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
| D、Fe3O4溶于稀硫酸:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com