
【题目】现有一定量![]() 和
和![]() 的混合溶液,向该混合溶液中逐滴加入
的混合溶液,向该混合溶液中逐滴加入![]() 溶液,加热使之充分反应,直至
溶液,加热使之充分反应,直至![]() 溶液过量。图甲表示产生沉淀的质量与加入
溶液过量。图甲表示产生沉淀的质量与加入![]() 溶液的体积之间的关系,图乙表示放出
溶液的体积之间的关系,图乙表示放出![]() 的体积(标准状况下)与加入
的体积(标准状况下)与加入![]() 溶液的体积之间的关系(假设
溶液的体积之间的关系(假设![]() 全部放出)。
全部放出)。

(1)混合溶液中![]() 的物质的量为______
的物质的量为______![]() 。
。
(2)混合溶液中![]() 的物质的量为______
的物质的量为______![]() 。
。
(3)当加入的![]() 溶液的体积在
溶液的体积在![]() 之间时,发生反应的离子方程式为______。
之间时,发生反应的离子方程式为______。
科目:高中化学 来源: 题型:
【题目】已知一定温度下,X(g)+2Y(g)![]() mZ(g);ΔH=-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
mZ(g);ΔH=-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A.a=bB.2a<cC.m>3D.m<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)溶液是实验和科研中一种常用氧化剂。酸性条件下,Cr2O72—通常被还原为Cr3+。
(1)某同学欲用K2Cr2O7固体配制500 mL 0.04000 mol·L-1的K2Cr2O7溶液。
①需用的玻璃仪器有烧杯、玻璃棒、量筒、 ____。
②应该称取K2Cr2O7固体的质量为______。
(2)交警常用装有重铬酸钾酒精测试仪检测司机是否酒后驾车,其化学反应原理如下:2K2Cr2O7+3C2H5OH+8H2SO4===2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O。每有1 mol C2H5OH发生反应,转移电子的物质的量是__。
(3)由两种阳离子和一种阴离子组成的化合物X(不带结晶水)。将两份质量相等的化合物X,分别配成溶液,分别进行如下实验:
步骤1:向其中一份溶液中加入足量Ba(OH)2溶液并加热,有气体逸出,该气体能使湿润的红色石蕊试纸变蓝,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理上述沉淀物,经洗涤和干燥,得到白色固体2.33 g。
步骤2:将另一份溶液与0.04000 mol·L-1的酸性K2Cr2O7溶液反应,消耗K2Cr2O7溶液20.84 mL。
试通过计算确定化合物X的化学式______。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是______。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_____,工艺师常用_____(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是_____。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于1mol·L-1的H2C2O4溶液的理解正确的是( )
A.加水稀释过程中,溶液的pH减小
B.c(H2C2O4)+c(HC2O4-)+c(C2O42-)=1mol·L-1
C.溶液中,1mol·L-1<c(H+)<2mol·L-1
D.溶液中,H2C2O4电离出的c(H+):c(C2O42-)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,反应A(g)+2B(g)![]() C(g)分别在三种不同的实验条件下进行,它们的起始浓度分别为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1、c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法正确的是( )
C(g)分别在三种不同的实验条件下进行,它们的起始浓度分别为c(A)=0.100mol·L-1、c(B)=0.200mol·L-1、c(C)=0mol·L-1,反应物A的浓度随时间的变化如图所示。下列说法正确的是( )
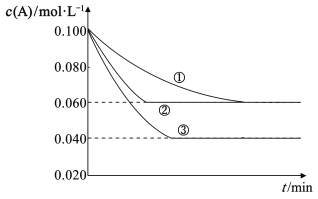
A.与①比较,②可能加入了催化剂
B.与①比较,③一定是增大了压强
C.实验③平衡时B的转化率为40%
D.该反应一定有ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,有体积和pH均相同的M和N两种溶液,加水稀释时,稀释的倍数与pH的变化关系如图所示:

①若两种溶液中的溶质分别为HCl和CH3COOH,则曲线___(填“I”或“II”)表示HCl溶液;当y=10时,x=___;稀释前,c(HCl)____c(CH3COOH)(填“>”“<”或“=”);
②若两种溶液中的溶质分别为HCl和NH4Cl,则a、b、c三点中,导电能力最强的是__;当向盐酸中加入n1molNaOH,向NH4Cl溶液中加入n2molNaOH时,两溶液恰好均呈中性,则n1__ n1(填“>”“<”或“=”)。
(2)已知常温下,0.1mol·L-1的NaHX溶液中,c(X2-)=1×10-3mol·L-1,且溶液中不存在H2X分子。
①HX-的电离方程式为___,常温下,HX-的电离平衡常数K=___;
②浓度为0.1mol·L-1的H2X溶液的pH=___;
③0.1mol·L-1的NaHX溶液中离子浓度由大到小排列的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
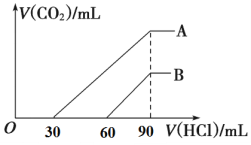
(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com