
【题目】(1)25℃时,有体积和pH均相同的M和N两种溶液,加水稀释时,稀释的倍数与pH的变化关系如图所示:

①若两种溶液中的溶质分别为HCl和CH3COOH,则曲线___(填“I”或“II”)表示HCl溶液;当y=10时,x=___;稀释前,c(HCl)____c(CH3COOH)(填“>”“<”或“=”);
②若两种溶液中的溶质分别为HCl和NH4Cl,则a、b、c三点中,导电能力最强的是__;当向盐酸中加入n1molNaOH,向NH4Cl溶液中加入n2molNaOH时,两溶液恰好均呈中性,则n1__ n1(填“>”“<”或“=”)。
(2)已知常温下,0.1mol·L-1的NaHX溶液中,c(X2-)=1×10-3mol·L-1,且溶液中不存在H2X分子。
①HX-的电离方程式为___,常温下,HX-的电离平衡常数K=___;
②浓度为0.1mol·L-1的H2X溶液的pH=___;
③0.1mol·L-1的NaHX溶液中离子浓度由大到小排列的顺序为____________。
【答案】I 5 < a < HX-![]() H++X2- 1.0×10-5 1 c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)
H++X2- 1.0×10-5 1 c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)
【解析】
(1)①若两种溶质分别为盐酸和醋酸,加水稀释时,盐酸的电离程度增加,故Ⅰ为盐酸的曲线;加水稀释10倍时,盐酸溶液中H+浓度减小10倍。溶液pH变为5,则x=5,;稀释两溶液的pH相同,因醋酸为弱酸,在水溶液中部分电离,故醋酸浓度大于盐酸浓度;
②若两种溶质分别为盐酸和氯化铵,加水稀释时,盐酸的电离程度增加故Ⅰ为盐酸的曲线,此时a点的导电能力最强,盐酸的浓度小于氯化铵的浓度,此时向二者加入氢氧化钠溶液使两溶液的pH相同等于7,则盐酸需要的NaOH的物质的量小于氯化铵需要的物质的量;
(2)①0.1mol/L的NaHX溶液中X2-的浓度为0.001mol/L,说明X2-为弱酸根,故HX-的电离方程式为HX-![]() H++X2-;常温下HX-的电离平衡常数K=
H++X2-;常温下HX-的电离平衡常数K=![]() =
=![]() 10-5;
10-5;
②溶液中不存在H2X,说明H2X的一级电离是完全电离,故0.1mol/L H2X的pH=1;
③NaHX溶液呈酸性,不发生水解反应,HX-发生电离,则溶液中各离子浓度从大到小的顺序为c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如下:
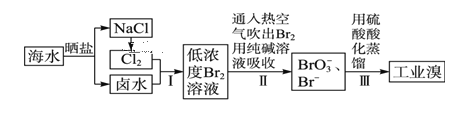
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_______。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的__________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面横线上填入适当的化学计量数:_____Br2+_____CO32-=_____ BrO3-+_____Br-+_____CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是__________。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量![]() 和
和![]() 的混合溶液,向该混合溶液中逐滴加入
的混合溶液,向该混合溶液中逐滴加入![]() 溶液,加热使之充分反应,直至
溶液,加热使之充分反应,直至![]() 溶液过量。图甲表示产生沉淀的质量与加入
溶液过量。图甲表示产生沉淀的质量与加入![]() 溶液的体积之间的关系,图乙表示放出
溶液的体积之间的关系,图乙表示放出![]() 的体积(标准状况下)与加入
的体积(标准状况下)与加入![]() 溶液的体积之间的关系(假设
溶液的体积之间的关系(假设![]() 全部放出)。
全部放出)。

(1)混合溶液中![]() 的物质的量为______
的物质的量为______![]() 。
。
(2)混合溶液中![]() 的物质的量为______
的物质的量为______![]() 。
。
(3)当加入的![]() 溶液的体积在
溶液的体积在![]() 之间时,发生反应的离子方程式为______。
之间时,发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。

(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。

回答下列问题:
(1)写出C的化学式:________;
(2)在上图D→B的过程中,D表现出强_____(填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的的是
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:N>C>Si | 稀硝酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 验证氧化性:Cl2>Br2 | 浓盐酸 | KMnO4 | FeBr2溶液 | |
C | 验证SO2有还原性 | 浓硫酸 | Na2SO3 | KMnO4溶液 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸
B.用二氧化硅和焦炭制取单质硅时,当生成![]() 气体(标准状况下)时,得到
气体(标准状况下)时,得到![]() 硅
硅
C.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温条件下发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
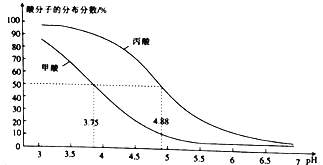
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com