
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )

A. 简单离子的半径:X<Z<M
B. 最高价氧化物对应水化物的酸性:R<N
C. Y、R两种元素的气态氢化物稳定性:Y>R
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度ρg/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A.ρ=(17V+22400)/(22.4+22.4V) B.W=17c/(1000ρ)
C.W=17V/(17V+22400) D.C=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
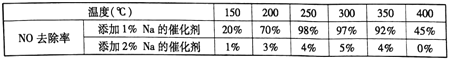
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
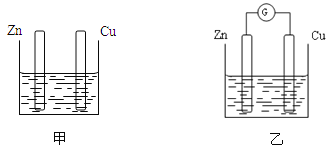
(1)以下叙述中,正确的是 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为 ,乙为 。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了少量气体,分析其原因可能是 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于植物细胞中元素的叙述,错误的是
A. 番茄和水稻根系吸Si元素的量有差异
B. 细胞中含量最多的四种元素是C、O、H和N
C. 植物根系通过主动运输吸收无机离子需要ATP
D. 细胞膜的选择透过性与膜蛋白有关,与脂质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于X、Y、Z三种元素,有以下五点信息
① X、Y、Z的单质在常温下均为气体;
② X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③ XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
④ 每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤ Z单质溶于X2Y中,所得溶液具有漂白性。
(1)试写出Z的元素符号______;化合物XZ的电子式:_______,X2Y的结构式_________。
(2)用电子式表示XZ的形成过程_________________________________________________。
(3)写出信息⑤中的化学方程式__________________________________________________。
(4)X2、Y2和KOH溶液一起可以构成新型燃料电池,写出该电池的总反应方程式:
_______________________
已知拆开1mol X—X键、1mol Z—Z键、1mol X—Z键分别需要吸收的能量为436kJ、243kJ、432kJ,计算反应X2(g)+Z2(g)=2XZ(g)的ΔH=________kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
A.该合成中所有的电能和热能全部转化为化学能
B.该合成氨过程不属于氮的固定
C.空气、水、太阳能均为可再生资源
D.断裂N2中的N≡N键会释放出能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com