
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
【答案】CH3COONa NH4Cl 1×10(a-14)mol/L c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+) 1:4
【解析】
①A、C溶液的pH均大于7,应为醋酸盐和碱的溶液,A、B的溶液中水的电离程度相同,则溶液中水解程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象,说明C为氢氧化钡,D为硫酸钠,B为氯化铵,A为醋酸钠。
(1)根据上述分析知道A为CH3COONa,B为NH4Cl;
(2)在氯化铵中存在电荷守恒c(OH-)+= c(Cl-)= c(NH4+)+ c(H+),原子守恒, c(Cl-)= c(NH4+)+ c(NH3·H2O),根据两个等式可以得出c(H+)-c(NH3·H2O)=c(OH-)=1×10(a-14)mol/L;
(3)等体积等物质的量浓度的氯化铵和氢氧化钡婚反应后溶质是氯化钡和氢氧化钡和一水合氨,则有c(OH-)> c(Ba2+) = c(Cl-)> c(NH4+)> c(H+);
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度为10-3mol/L,设氢氧化钠的体积为x,盐酸的体积为y,则有c(OH-)= ![]() =10-3,解x:y=1:4。
=10-3,解x:y=1:4。


科目:高中化学 来源: 题型:
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
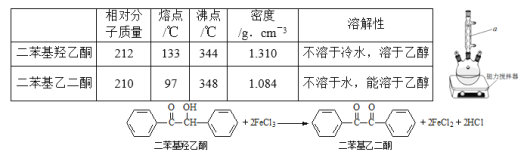
在反应装置中,加入10ml冰醋酸、5.50gFeCl3固体、10ml水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤 →冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)装置图中仪器a的名称是_______________,其作用是______________。
(2)加入碎瓷片的作用是________。若加热后发现未加碎瓷片,应采取的正确方法是____________________________________________________。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。下图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:
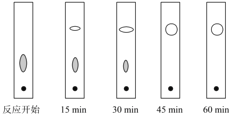
该实验条件下加热________后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____________(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是_________________________。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是______________________。
(7)本实验的产率是_________%。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量的不同,溶液M的组成也不同,若向M中加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计CO2的溶解)
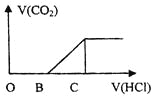
A.若OB=0,则形成溶液M所发生的离子方程式为OH-+CO2=![]()
B.若OB=BC,则溶液M为![]() 溶液
溶液
C.若OB>BC,则溶液M中大量存在的阴离子为![]() 和
和![]()
D.若3OB=BC,则溶液M中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是________(填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:_________________
(3)滴定数据如下:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.40 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为_________(填离子)对该反应具有催化作用,KMnO4溶液应装在_____(填“酸”或“碱”)式滴定管中;滴定终点的现象是_____________________。
②该草酸溶液的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
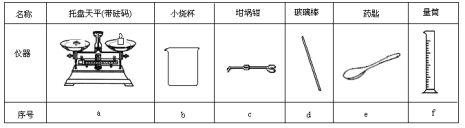
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
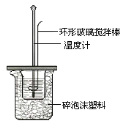
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
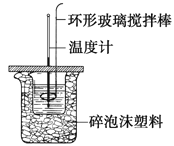
步骤一:用量筒量取50ml 0.50 molL-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 molL-1NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液的酸碱性说法正确的是
A.含OH-的溶液一定呈碱性B.在100°C时,纯水的pH<7,因此显酸性
C.c(H+)=c(OH-)的溶液一定呈中性D.pH=14的溶液碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化学平衡mA(g)+nB(g)![]() pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
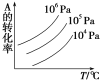
A.正反应是吸热反应;m+n<p+q
B.正反应是放热反应;m+n>p+q
C.正反应是放热反应;m+n<p+q
D.正反应是吸热反应;m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苏合香酯![]()

![]() 是配制栀子、晚香玉香型日用香精的主要原料。一种合成乙酸苏合香酯的设计线路如下:
是配制栀子、晚香玉香型日用香精的主要原料。一种合成乙酸苏合香酯的设计线路如下:
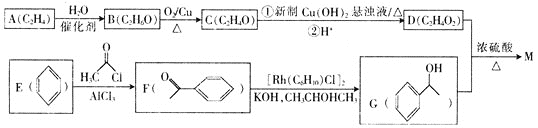
请回答下列问题:
![]() 的名称是________,C中官能团的名称是________。
的名称是________,C中官能团的名称是________。
![]() A→B的反应类型是________,G的分子式为________。
A→B的反应类型是________,G的分子式为________。
![]() 的核磁共振氢谱有________组吸收峰。
的核磁共振氢谱有________组吸收峰。
![]() 写出D与G反应生成M的化学方程式:________________________________________。
写出D与G反应生成M的化学方程式:________________________________________。
![]() 是M的同分异构体,同时符合下列条件的X共有________种。
是M的同分异构体,同时符合下列条件的X共有________种。
![]() 苯环上只有两个取代基
苯环上只有两个取代基 ![]() 能发生银镜反应
能发生银镜反应 ![]() 能发生水解反应
能发生水解反应
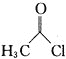
![]() 请设计以甲苯和乙酰氯
请设计以甲苯和乙酰氯![]()
![]() 为原料合成
为原料合成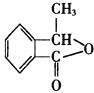 的合理路线______________。已知:若苯环上连烷基,则苯环上的邻、对位的氢原子易被取代;若苯环上连羧基,则苯环上的间位的氢原子易被取代。
的合理路线______________。已知:若苯环上连烷基,则苯环上的邻、对位的氢原子易被取代;若苯环上连羧基,则苯环上的间位的氢原子易被取代。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com