
【题目】中和滴定是高中化学重要的定量实验。请回答下列问题:
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是________(填选项字母)。
A.滴定终点读数时,俯视滴定管刻度
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.02 mol·L-1的高锰酸钾溶液滴定,发生反应的离子方程式为:_________________
(3)滴定数据如下:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.40 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为_________(填离子)对该反应具有催化作用,KMnO4溶液应装在_____(填“酸”或“碱”)式滴定管中;滴定终点的现象是_____________________。
②该草酸溶液的物质的量浓度为____________。
【答案】CD 2MnO4-+5H2C2O4+6H+![]() 10CO2↑+2Mn2++8H2O Mn2+ 酸 当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色 0.04mol·L-1
10CO2↑+2Mn2++8H2O Mn2+ 酸 当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色 0.04mol·L-1
【解析】
(1)根据c(待测)=![]() 分析误差;
分析误差;
(2)酸性条件下,高锰酸钾具有强氧化性,草酸具有还原性,二者发生氧化还原反应生成硫酸锰,硫酸钾和二氧化碳;
(3)①产物中Mn2+具有催化作用;KMnO4溶液具有强氧化性分析;滴定终点的现象根据颜色改变分析;
②根据2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O计算。
(1)A.滴定终点读数时,俯视滴定管刻度,其他操作正确,导致V(标准)偏小,根据c(待测)=![]() 分析,测定结果偏低,故A错误;
分析,测定结果偏低,故A错误;
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗,此操作正确,不影响测定结果,故B错误;
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,导致标准液浓度减小,导致V(标准)增大,根据c(待测)=![]() 分析,测定结果偏高,故C正确;
分析,测定结果偏高,故C正确;
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失,导致V(标准)增大,根据c(待测)=![]() 分析,测定结果偏高,故D正确;
分析,测定结果偏高,故D正确;
答案:CD;
(2)高锰酸钾与草酸发生氧化还原反应生成硫酸锰,硫酸钾、二氧化碳和水,离子方程式为2MnO4-+5H2C2O4+6H+![]() 10CO2↑+2Mn2++8H2O;
10CO2↑+2Mn2++8H2O;
答案:2MnO4-+5H2C2O4+6H+![]() 10CO2↑+2Mn2++8H2O;
10CO2↑+2Mn2++8H2O;
(3)①滴定时,该反应速率开始十分缓慢,一段时间后突然加快,这是因为生成的Mn2+对该反应具有催化作用;高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,所以应该使用酸式滴定管盛装高锰酸钾溶液;滴定结束前混合液为无色,滴定结束时混合液变成了红色,所以滴定终点现象为当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色;
答案:Mn2+ 酸 当加入最后一滴KMnO4后,锥形瓶中溶液由无色变为红色,且半分钟内不褪色;
②三次滴定消耗标准液体积为19.90mL,20.40mL,20.10mL,第二次数据误差太大,删掉,消耗标准液的平均体积为:![]() ==20.00mL,高锰酸钾的物质的量为:0.02mol/L×0.020L=0.0004mol,由2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,n(H2C2O4)=
==20.00mL,高锰酸钾的物质的量为:0.02mol/L×0.020L=0.0004mol,由2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O可知,n(H2C2O4)=![]() n(KMnO4)=0.001mol,待测液草酸的物质的量浓度为:
n(KMnO4)=0.001mol,待测液草酸的物质的量浓度为:![]() =0.04mol·L-1;
=0.04mol·L-1;
答案:0.04mol·L-1。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸、再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为
A. 0.1mol B. 0.2mol
C. 大于或等于0.2mo1,小于0.3mol D. 大于0.1mol,小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缩醛是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。G可以由如图途径合成:

已知:I.A的分子式为C7H8,属于芳香烃;D的产量可以用来衡量一个国家石油化工发展水平;
Ⅱ.缩醛化反应原理:

Ⅲ.同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)F的名称为______________________。
(2)写出由A生成B的化学方程式:______________________。
(3)反应①的条件为___________;反应②的反应类型为___________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉效率高、污染物少的优点,维生素C的结构简式为 。则维生素C分子中含氧官能团的名称为___________、___________。
。则维生素C分子中含氧官能团的名称为___________、___________。
(5)缩醛G的结构简式为___________。同时满足下列条件的G的同分异构体有___________种(不考虑立体异构);其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为______________________。
①苯环上只有两个取代基
②既能发生银镜反应,又能与FeCl3溶液发生显色反应
(6)D的一种含4个碳原子的无支链同系物H,所有碳原子一定在同一平面上。H作为原料可用于制取目前产量居第二位的顺丁橡胶。试写出该合成路线(其他试剂任选):______________________ ![]() 顺丁橡胶。
顺丁橡胶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
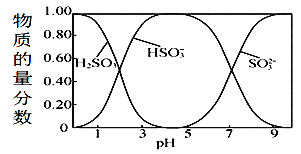
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】技术的发展与创新永无止境,我国化工专家侯德榜改革国外路布兰、索尔维的纯碱生产工艺,使生产纯碱的成本明显降低。生产流程可简要表示如图:

(1)向沉淀池中通入CO2和氨气,应先通入___________(填化学式)。
(2)沉淀池中发生反应的化学方程式___________。
(3)向母液中通氨气后再加入细小食盐颗粒,冷却析出的副产品是___________,加入细小食盐颗粒的作用是___________。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为___________(填化学式)。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________。
(5)侯氏制碱法制得的纯碱中含有碳酸氢钠杂质。现用沉淀法测定纯碱的纯度,取m1g样品,加水溶解,再加过量的CaCl2溶液,充分反应后,过滤、洗涤、干燥后称得沉淀的质量为m2g。则此样品中碳酸钠的纯度为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是由于发生了加成反应
B.海产品可用福尔马林浸泡防腐保鲜
C.煤经过气化一液化等物理变化可以转化为清洁燃料
D.粮食酿酒经过了淀粉![]() 葡萄糖
葡萄糖![]() 乙醇的化学变化过程
乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com