
【题目】分枝酸可用于生化研究 , 其结构简式如图。下列关于分枝酸的叙述正确的是( )

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol分枝酸最多可与3 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管的底部向上套,夹在试管的中上部 ②给盛有液体超过试管容积![]() 的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽向试管里送入固体粉末,然后使试管竖立起来 ⑤取用放在细口瓶里的液体时,取下瓶塞倒放在桌面上,倾倒液体时,标签向着地面 ⑥将烧瓶放在桌面上,再将塞子用力塞上 ⑦用坩埚钳夹持加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒进盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手掌握住容器或用酒精灯微热
的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽向试管里送入固体粉末,然后使试管竖立起来 ⑤取用放在细口瓶里的液体时,取下瓶塞倒放在桌面上,倾倒液体时,标签向着地面 ⑥将烧瓶放在桌面上,再将塞子用力塞上 ⑦用坩埚钳夹持加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒进盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手掌握住容器或用酒精灯微热
A.①④⑦⑩
B.①④⑤⑦⑩
C.①④⑤⑦⑧⑨
D.④⑤⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。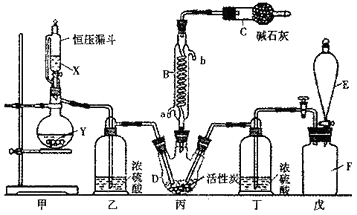
(1)仪器E的名称是 , 由B的使用可知SO2与氯气之间的反应属于(填“放”或“吸”)热反应,B处反应管冷却水应从 (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是。
(2)试剂X、Y的组合最好是。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是 .
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为 %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定是化学定量实验之一.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白: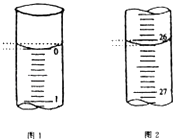
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是 . (写序号)
(2)选用的指示剂是 . (a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 .
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .
(7)滴定终点的判定依据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.5×10﹣16 , Ksp(AgBr)=7.7×10﹣13 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>AgBr
B.AgCl>AgBr>AgI
C.AgBr>AgCl>AgI
D.AgBr>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
(1)请写出:D基态原子的价层电子排图:; F 基态原子的外围电子排布式: .
(2)下列说法错误的是 .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2 .
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似.
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键.
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+ , 该离子的结构式为(用元素符号表示).
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有 . 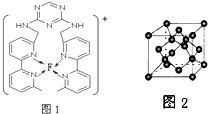
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 .
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应
B.四川灾区重建使用了大量钢材,钢材是合金
C.金属材料都是导体,非金属材料都是绝缘体
D.合金材料中可能含有非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得BeCl2为共价化合物,两个Be﹣Cl键间的夹角为180°,由此可判断BeCl2属于( )
A.由极性键形成的极性分子
B.由极性键形成的非极性分子
C.由非极性键形成的极性分子
D.由非极性键形成的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com