
 如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
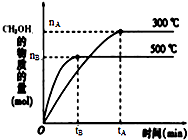 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
| 0.12 | 0.06 | 0.10 | t1 |
| 0.06 | 0.12 | 0.20 | t2 |
A、0~t1时间段内,平均反应速率v(B)=
| ||
B、若起始时n(D)=0,则t2时v(D)=
| ||
| C、升高温度,v(B)、vC)、v(D)均增大 | ||
| D、b:d=6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②③④ | C、只有④ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
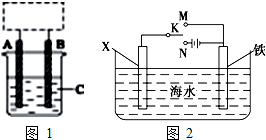 I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:
I.某学生设计了如图1所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com