
| A、在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA |
| B、常温常压下,16g O3所含的电子数为8NA |
| C、0.1mol Na2O2晶体中含有0.4NA个离子 |
| D、铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |


科目:高中化学 来源: 题型:
| A、热稳定性:HCl>PH3>H2S |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、原子半径:Na>S>O |
| D、结合氢离子能力:CO32->HCO3->SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时,负极反应式为3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时,正极区溶液的pH减小 |
| C、充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、充电时,电池的锌电极接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
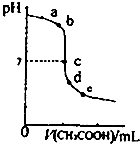 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3mol | B、6mol |
| C、11mol | D、12mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
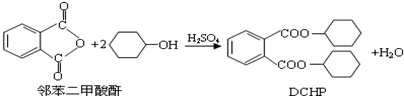
| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚显酸性,是因为羟基对苯环影响的结果 |
| B、分子式为C2H4和C3H6的物质一定互为同系物 |
C、聚合物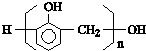 是苯酚和甲醛在一定条件下反应得到的高分子化合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 |
D、1mol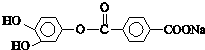 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com