
【题目】部分被氧化的铝箔5.01 g,加入足量的10%的稀盐酸,充分反应后收集到0.5 g氢气。
(1)被氧化的金属铝的质量为多少克?__________________
(2)参加反应的稀盐酸的质量为多少克?____________________
【答案】被氧化的金属铝的质量为0.27 g 参加反应的稀盐酸的质量为193.45 g
【解析】
(1)根据生成的氢气的质量结合反应方程式计算参与反应的铝的质量,再计算被氧化的金属铝的质量;
(2)参加反应的稀盐酸的总量等于与铝反应的盐酸和与氧化铝反应的盐酸的物质的量之和,再根据浓度(质量分数)计算参加反应的稀盐酸的质量。
(1)设与盐酸反应的Al的质量为x,与铝反应的HCl的物质的量为y,
2Al + 6HCl=2AlCl3+ 3H2↑
54g 6mol 6g
x y 0.5g
![]() =
=![]() =
=![]() 解得:x=4.5 g,y=0.5 mol,m(Al2O3)=5.01g-4.5g=0.51 g,n(Al2O3)=
解得:x=4.5 g,y=0.5 mol,m(Al2O3)=5.01g-4.5g=0.51 g,n(Al2O3)=![]() =0.005 mol,被氧化n(Al)=0.005 mol×2= 0.01 mol,即被氧化的Al的质量为0.01 mol ×27g/mol=0.27 g,故答案为:0.27 g;
=0.005 mol,被氧化n(Al)=0.005 mol×2= 0.01 mol,即被氧化的Al的质量为0.01 mol ×27g/mol=0.27 g,故答案为:0.27 g;
(2)Al2O3 + 6HCl=2AlCl3+ 3H2O
0.005mol 0.03mol
参加反应的HCl总量=0.5 mol+0.03 mol=0.53 mol,m(HCl)=0.53 mol ×36.5g/mol=19.345g,需要10%的稀盐酸![]() =193.45g,故答案为:193.45g。
=193.45g,故答案为:193.45g。


科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升。
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
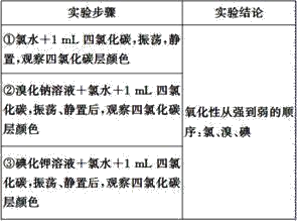
实验药品:溴化钠溶液、碘化钾溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是__、__。
(2)②中反应的化学方程式为__;③中反应的离子方程式为__。
(3)四氯化碳在实验中所起的作用是__。
(4)该同学的实验设计不足之处是__,改进的办法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知28 g CuO和MgO的固体混合物与200 mL某H2SO4溶液恰好完全反应,将反应后的溶液小心蒸干,得到固体68 g。则原H2SO4溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5 mol·L-1 28.57%B.2.2 mol·L-1 23.07%
C.1.5 mol·L-1 24.55%D.2.5 mol·L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
N2(g)+2CO2(g) △H=a kJ/mol。T K时,在2 L恒容密闭容器中充入2mol NO 和2mol CO,保持温度不变,5 min后反应达到平衡状态,此时c(N2)=0.4mol/L。下列说法中错误的是
A.若该反应是放热反应,则a<0
B.用NO表示的平均化学反应速率v(NO)为0.16mol/(L·min)
C.达到化学平衡时,CO的转化率是80%
D.保持温度不变,若再向上述达到平衡的体系中充入2mol NO 和2mol CO,则反应重新达到平衡时c(N2)等于0.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现实验室需要用质量分数:98%、密度:1.84g/cm3的浓硫酸配制240mL4.6mol/L的稀硫酸,下列说法中正确的是( )
A.该浓硫酸的物质的量浓度为18.4mol/L
B.需要该浓硫酸的体积为60mL。
C.配制稀硫酸时,将量好的浓硫酸注入容量瓶中,并加入适量的水
D.该同学实际配制得到的浓度为4.8mol/L,可能的原因是量筒量取浓硫酸时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析比较氧化铁和氧化亚铁的性质:
(1)写出下列反应的化学方程式:
①氧化铁与一氧化碳反应______________________;
②氧化铁与铝发生铝热反应____________________;
③氢气还原氧化亚铁________________________;
④氧化亚铁在高温下转化为四氧化三铁_____________________。
(2)上述各反应中氧化铁或氧化亚铁表现的氧化性或还原性:
①___________________;②____________________;
③___________________;④_____________________。
(3)从铁元素的化合价分析说明:
①氧化铁具有的性质_______________________________。
②氧化亚铁具有的性质_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学想测量某赤铁矿样品中氧化铁的纯度(假设其他成分不与酸反应,也不溶于水),进行了如下实验:称取10.00 g赤铁矿样品,加入到烧杯中,再加入92.50 g 的稀硫酸,恰好完全反应,过滤得滤渣2.50 g。试计算:
(1)赤铁矿样品中氧化铁的质量分数?___________
(2)上述反应后所得滤液中溶质的质量分数?___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com