
【题目】我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
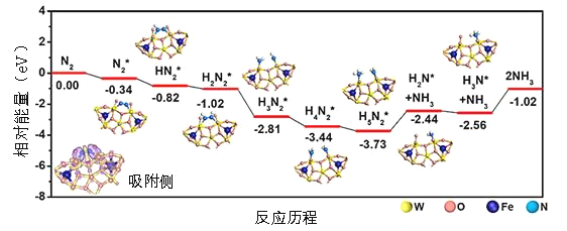
(1)需要吸收能量最大的能垒(活化能)E=__ev,该步骤的化学方程式为___;
(2)对于合成氨反应N2+3H2![]() 2NH3,在标况下,平衡常数Kθ=
2NH3,在标况下,平衡常数Kθ=![]() ,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
①若起始N2和H2物质的量之比为1:3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=___(用含ɑ的最简式表示)。
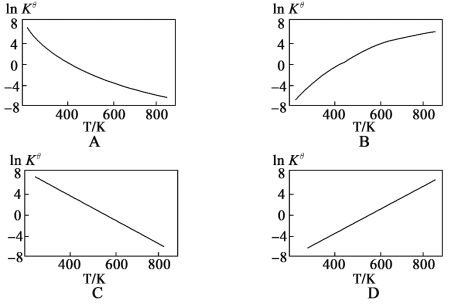
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___(填序号).
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
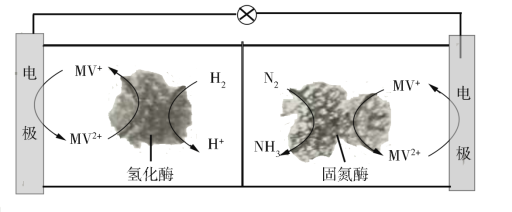
该电池工作时,正极的电极反应为___。中间所用的交换膜应该为___(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。相比现有工业合成氨,该方法的优点是:___。(任写一条)
【答案】1.54 NH3*+NH3=2NH3 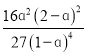 A MV2++e-=MV+ 质子交换膜 条件温和、生成氨的同时释放电能
A MV2++e-=MV+ 质子交换膜 条件温和、生成氨的同时释放电能
【解析】
(1)吸收能量最大的能垒,即相对能量的差最大;根据图示写方程式;
(2)①若1mol N2和3mol H2完全反应,则理论上生成2molNH3,NH3的平衡产率为ɑ,则生成的NH3为2ɑmol,通过三段式计算有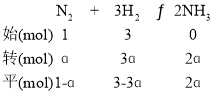 ,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=
,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=![]() pθ,p(N2)=
pθ,p(N2)= ![]() pθ,p(H2)=
pθ,p(H2)= ![]() pθ,根据Kθ=
pθ,根据Kθ=![]() 计算;
计算;
②升高温度,平衡逆向移动,Kθ减小;
(3)生物燃料电池的工作原理是N2+3H2![]() 2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
2NH3,其中N2在正极区得电子发生还原反应,H2在负极区失电子发生氧化反应,原电池工作时阳离子向正极区移动,据此分析判断。
(1)根据图示,吸收能量最大的能垒,即相对能量的差最大是-1.02-(-2.56)=1.54;根据图示,该步的方程式是NH3*+NH3=2NH3,故答案为:1.54;NH3*+NH3=2NH3;
(2) ①若1mol N2和3mol H2完全反应,则理论上生成2molNH3,NH3的平衡产率为ɑ,则生成的NH3为2ɑmol,通过三段式计算有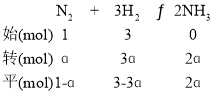 ,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=
,平衡时混合气体的物质的量=1-ɑ +3-3ɑ+2ɑ=4-2ɑmol,此时p(NH3)=![]() pθ,p(N2)=
pθ,p(N2)= ![]() pθ,p(H2)=
pθ,p(H2)= ![]() pθ,根据Kθ=
pθ,根据Kθ=![]() =
=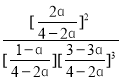 =
=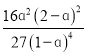 ,故答案为:
,故答案为: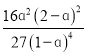 ;
;
②升高温度,平衡逆向移动,Kθ减小,ln Kθ减小,因此变化趋势的图为A,故答案为:A;
(3)正极区发生还原反应,电极上的反应为:MV2++e-=MV+;右室氮气得电子,为正极区,氮气在固氮酶催化作用下发生反应N2+6MV++6H+=2NH3+6MV2+,阳离子由负极移向正极,所以电池工作时,氢离子通过交换膜由负极区向正极区移动,交换膜应该为质子交换膜;传统工业合成氨反应条件为高温、高压、催化剂,反应条件苛刻,该方法制取氨气条件温和、生成氨的同时释放电能,故答案为:MV2++e-=MV+;质子交换膜;条件温和、生成氨的同时释放电能。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是
A.35Cl原子所含质子数为18B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为71 g / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | H | ||||||
2 | C | ||||||
3 | Na | Mg | P | S | Cl |
(1)周期表中第三周期第ⅡA族的元素是_____。
(2)P、S、Cl三种元素中,非金属性最强的是____(填元素符号)。
(3)钠元素最高价氧化物对应水化物的化学式是____,常温下该水化物溶液的pH____(填“>”“<”或“=”)7。
(4)如图为木炭在氧气中燃烧的能量变化图,此反应为____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种金属单质A,焰色反应颜色呈黄色,能发生如图所示变化:

上图中淡黄色固体B是_____________(填化学式)
(2)二氧化氮(NO2)是一种红棕色的有毒气体,二氧化氮与水反应生成硝酸和___。
(3)写出(1)中C溶液与硝酸反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充放电的化学方程式为2K2S2+KI3![]() K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI;装置(Ⅱ)为电解池的示意图,当闭合开关K时,X附近溶液先变红。则下列说法正确的是![]() ( )
( )
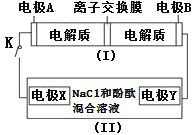
A.闭合K时,K+从左到右通过离子交换膜
B.闭合K时,电极X是阳极
C.闭合K时,电极A的反应式为3I--2e-=I3-
D.闭合K时,当有0.1molK+通过离子交换膜,X电极上产生气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
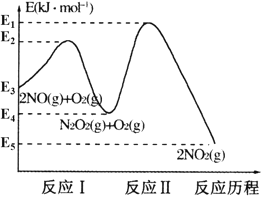
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如图所示:
回答下列问题:
(1)写出反应I的热化学方程式___。
(2)反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是___(反应未使用催化剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用10 mol/L的浓盐酸配制250mL 1 mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸_________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、______等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g ;设反应后溶液的体积仍为100 mL ,则反应后溶液中H+的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2![]() 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com