
【题目】氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是
A.35Cl原子所含质子数为18B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为71 g / mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有①BaCl2②金刚石 ③KOH ④H2SO4⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力结合的是________。
(3)请写出③的电子式______,⑤的电子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
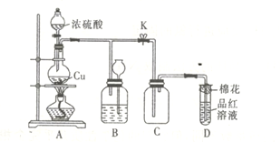
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
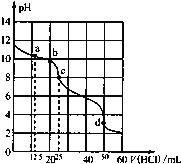
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
(实验一)制取NaNO2
该小组先查阅资料知:①2NO+Na2O2→2NaNO2;2NO2+Na2O2→2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如图(夹持装置略去):
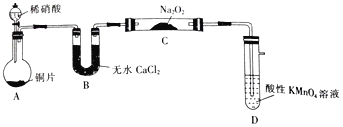
(1)装置D的作用是_______________;如果没有B装置,C中发生的副反应有_______________。
(2)就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是由_____________;设计一种提高NaNO2纯度的改进措施_________。
(实验二)测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+2MnO4-+6H+→5NO3-+3Mn2++3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度:
样品→溶液A ![]() 溶液B
溶液B ![]() 数据处理
数据处理
(3)取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应.反应后的溶液用0.1000 mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________.
(4)通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是_________。(填字母编号)
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法合成氨的装置如图所示,该法采用高质子导电性的 SCY 陶瓷,用吸附在它内外表面上的金属 Pd 多晶薄膜做电极,实现了 570℃、常压下高转化率合成氨。下列叙述正确的是
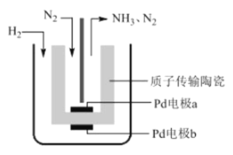
A.阴极的电极反应式为 N2 +8H+ +6e-=2NH4+
B.该装置工作时,H+ 从 a 极区向 b 极区迁移
C.每生成 1mol NH3 ,有 3g H2 被氧化
D.该装置实现了在常温常压下高转化率合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18O49纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
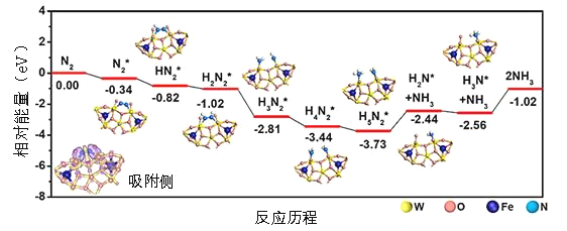
(1)需要吸收能量最大的能垒(活化能)E=__ev,该步骤的化学方程式为___;
(2)对于合成氨反应N2+3H2![]() 2NH3,在标况下,平衡常数Kθ=
2NH3,在标况下,平衡常数Kθ=![]() ,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
,其中pθ为标准压强(1×105Pa),p(NH3)、p(N2)和p(H2)为各组分的平衡分压[已知p(NH3)=x(NH3)p,其中p为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数]。
①若起始N2和H2物质的量之比为1:3,反应在恒定温度和标准压强下进行,达到平衡时H2的转化率为ɑ,则Kθ=___(用含ɑ的最简式表示)。
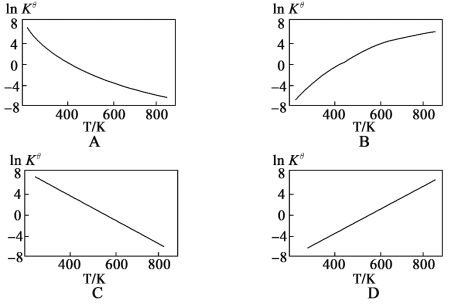
②图中可以示意标准平衡常数Kθ随温度T变化趋势的是___(填序号).
(3)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。
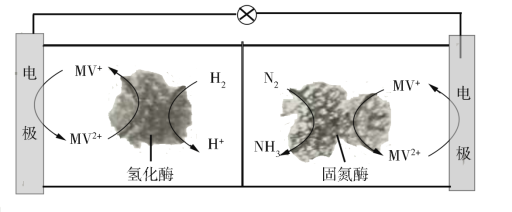
该电池工作时,正极的电极反应为___。中间所用的交换膜应该为___(填“阳离子交换膜”或“阴离子交换膜”或“质子交换膜”)。相比现有工业合成氨,该方法的优点是:___。(任写一条)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com