
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
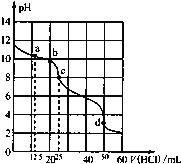
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
【答案】BD
【解析】
A.a点时n(HCl)=0.1 mol/L×0.0125 L=0.00125 mol,反应生成0.00125 mol NaHCO3,剩余0.00125 mol Na2CO3,由于CO32-的水解程度大于HCO3-的电离程度,则c(HCO3﹣)>c(CO32-),A错误;
B.b点时n(HCl)=0.1 mol/L×0.02 L=0.002 mol,由物料守恒可知5c(Cl﹣)=4c(HCO3﹣)+4c(CO32﹣)+4c(H2CO3),则5c(Cl﹣)>4c(HCO3﹣)+4c(CO32﹣),B正确;
C.c点时n(HCl)=0.1 mol/L×0.025 L=0.0025 mol,恰好完全反应生成NaHCO3,根据质子守恒可:c(OH-)=c(H+)+c(H2CO3)-c(CO32-),C错误;
D.d点时加入盐酸0.005 mol,溶液中溶质恰好反应产生NaCl、H2O、CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH﹣)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH﹣),D正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表在学习、研究和生产实践中有很重要的作用。①~⑥六种元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
请回答下列问题:
(1)⑥的元素符号为___________。
(2)由①③④形成的化合物是一种强碱,其化学式____________。
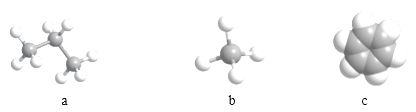
(3)由①②形成的最简单化合物的分子模型为_____________(填序号)
(4)⑤和⑥两种元素的最高价氧化物对应的水化物之间反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关离子交换法软化硬水的下列叙述中,正确的是( )
A.磺化煤能使具有永久硬度的水软化,是因为它能除去水中的Ca2+、Mg2+、S![]() 和Cl-等
和Cl-等
B.经磺化煤软化处理后,软水中Na+浓度增大
C.磺化煤使硬水软化以及磺化煤的再生,这两种操作可以在同一离子交换柱中同时进行
D.失去软化硬水能力的磺化煤,不可能恢复它的软化能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
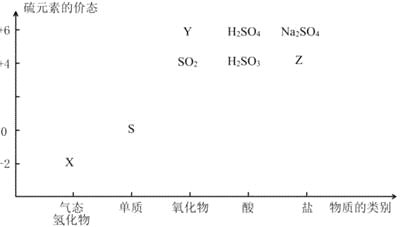
(1)上图中X的电子式为_________;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化__________;该变化体现出硫元素的非金属性比氧元素______(填“强”或“弱”)。用原子结构解释原因____________。
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: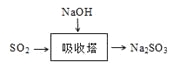 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫氢化钠的四种溶液的pH由大到小的顺序是________(用编号表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g)![]() S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为![]() ,则SO2的转化率为________。
,则SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是
A.35Cl原子所含质子数为18B.![]() mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为71 g / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种金属单质A,焰色反应颜色呈黄色,能发生如图所示变化:

上图中淡黄色固体B是_____________(填化学式)
(2)二氧化氮(NO2)是一种红棕色的有毒气体,二氧化氮与水反应生成硝酸和___。
(3)写出(1)中C溶液与硝酸反应的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com