
【题目】下列物质所含原子数最多的是
A.0.4mol硫酸B.5.1g氨气C.0.2mL水D.标准状态下2.24L的戊烷
【答案】D
【解析】
先计算分子的物质的量,再根据分子式计算原子的物质的量,即可比较。
A、硫酸的物质的量为0.4mol,每个硫酸分子有7个原子,故n(原子)=0.4mol![]() 7=2.8mol,原子数为2.8NA;
7=2.8mol,原子数为2.8NA;
B、n(NH3)=![]() =0.3mol,每个氨气分子有4个原子,n(原子)=0.3mol
=0.3mol,每个氨气分子有4个原子,n(原子)=0.3mol![]() 4=1.2mol,原子数为1.2NA;
4=1.2mol,原子数为1.2NA;
C、0.2mL水即0.2g,n(H2O)=![]() =
=![]() mol,每个水分子有3个原子,n(原子)=
mol,每个水分子有3个原子,n(原子)=![]() mol
mol![]() 3=
3=![]() mol,原子数为
mol,原子数为![]() NA;
NA;
D、标准状况下,戊烷是液态,故2.24L的质量远远大于0.1mol,且每个戊烷分子中有17个原子,故2.24L的戊烷含有的原子数肯定最多。
答案选D。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素。Z 的最高价氧化物对应的水化物为 M,室温下,0. 01 mol/L M 溶液 pH<2。下列说法中错误的是
W | X | ||
Y | Z |
A.原子半径大小:X<W<YB.Z 的单质易溶于化合物 WZ2
C.气态氢化物稳定性:W<XD.含 Y 元素的离子一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,0.1000mol/L Na2CO3溶液25mL用0.1000mol/L盐酸滴定,滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列说法正确的是
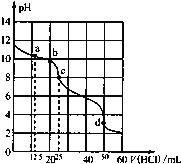
A.a点:c(CO32-)>c(HCO3﹣)>c(OH﹣)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3﹣)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1乙氧基萘常用作香料,也可合成其他香料。实验室制备1乙氧基萘的过程如下:
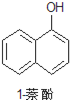 +CH3CH2OH
+CH3CH2OH![]()
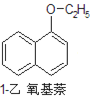 +H2O
+H2O
已知:1萘酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数:
物质 | 相对分子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醇 | |||||
1萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | 114.1℃ | 78.5℃ | 任意比混溶 | |
(1)将一定量1萘酚溶于无水乙醇中,并加入少量浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是__________。
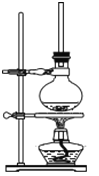
(2)装置中长玻璃管的作用是:______。
(3)该反应不能用实验室制备乙酸乙酯的装置,简述理由____________;
(4)反应结束,需要提纯产物,在下面的横线上填上相应操作的名称:倒入冷水,碱洗并_______ → 水洗并_______ →加入CaCl2干燥并______→___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法合成氨的装置如图所示,该法采用高质子导电性的 SCY 陶瓷,用吸附在它内外表面上的金属 Pd 多晶薄膜做电极,实现了 570℃、常压下高转化率合成氨。下列叙述正确的是
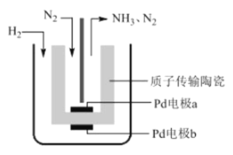
A.阴极的电极反应式为 N2 +8H+ +6e-=2NH4+
B.该装置工作时,H+ 从 a 极区向 b 极区迁移
C.每生成 1mol NH3 ,有 3g H2 被氧化
D.该装置实现了在常温常压下高转化率合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7.2H2O),其主要工艺流程如下图:
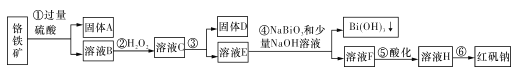
查阅资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的 pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)固体A的主要成分为____(填化学式)。
(2)步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5.0的目的是____。
(3)写出④反应的离子反应方程式:____。
(4)取一定质量的固体D溶解于200 mL的硫酸中,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则加入NaOH溶液体积为200~240 mL时发生反应的化学方程式为____,固体D中含铁化合物的物质的量为____

Ⅱ.经检测该化工厂的工业废水中含5.00×10-3mol/L的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Fe的化合价依次为+3、+2),又设计了如下工艺流程:
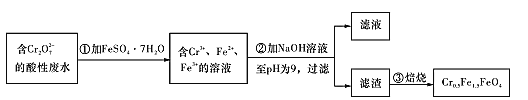
(5)第①步反应的离子方程式为____。
(6)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加FeSO4.7H2O的质量为 ___g(已知FeSO4.7H2O的摩尔质量为278 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.1000 mol· L -1的NaOH溶液滴定0. 1000 mol· L -1的顺丁烯二酸H2A的滴定曲线如下图所示(pKa= lgKa),下列说法错误的是
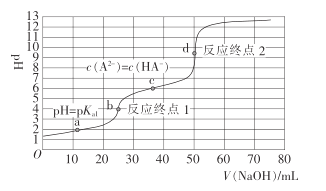
A.用NaOH溶液滴定NaHA溶液可用酚酞作指示剂
B.a点:c(HA-)=c(H2A)
C.H2A的Ka2=10-6
D.d点:c(Na+)<c(HA-)+2c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com